БОР
(от позднелат. borax - бура; лат. Borum) В, хим. элемент
III гр. периодич. системы, ат. н. 5, ат. м. 10,811. Прир. Б. состоит из
двух стабильных изотопов - 10В (19,57%) и 11В (80,43%).
Поперечное сечение захвата тепловых нейтронов 10B 3*10-25
м2, 11В 4*10-32 м2. Конфигурация
внеш. электронной оболочки 2s22р; степень окисления + 3, редко
+ 2; энергия ионизации при последоват. переходе от В° к В5+
соотв.
8,29811, 25,156, 37,92, 259,30 и 340,13 эВ; атомный радиус 0,097 нм, ковалентный
0,088 нм, металлический 0,091 нм, ионный В3+ 0,025 нм (координац.
число 4).
Содержание Б. в земной коре 5*10-3% по массе, в воде океанов
- 4,6 мг/л. В природе в своб. виде не встречается. Важнейшие минералы -
бура Na2B4O7*10Н2О, кернит
Na2B4O7*4HaO. На земной пов-сти
Б. мигрирует и концентрируется в рассолах озер и морей. Главные осадочные
бо-ратные месторождения находятся в СССР, США, ГДР. Мировые запасы Б. ок.
100 млн. т.
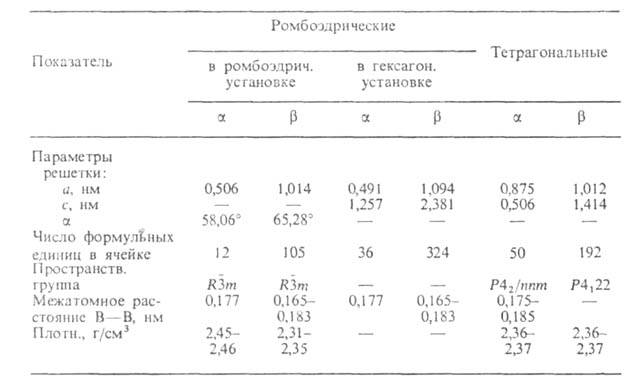
Свойства. Б. - бесцв., серое или красное кристаллическое либо
темное аморфное в-во. Известно более 10 алло-тропных модификаций Б., св-ва
важнейших приведены в таблице. Образование той или иной модификации и их
взаимные переходы определяются т-рой, при к-рой получают Б.: при 600-800°С
образуется аморфный продукт (плотн. 2,35 г/см3;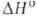 перехода аморфный
перехода аморфный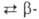 ромбоэдрич.
модификация 5,02 кДж/моль), до 1000°С-
ромбоэдрич.
модификация 5,02 кДж/моль), до 1000°С-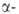 ромбоэдрич.
модификация (красные кристаллы), до 1200°С-
ромбоэдрич.
модификация (красные кристаллы), до 1200°С-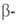 ромбоэдрическая (наиб, устойчивая форма), до 1500 °С - тетрагональные модификации.
Расплав обычно кристаллизуется в
ромбоэдрическая (наиб, устойчивая форма), до 1500 °С - тетрагональные модификации.
Расплав обычно кристаллизуется в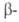 ромбоэдрич.
модификацию, в к-рую переходят и все остальные формы выше 1500°С. В интервале
1000-1500°С можно одновременно получить смесь разл. модификаций. Кристаллич.
решетки всех модификаций Б. построены из икосаэдров В12 - полиэдрич.
электронодефицитных структур, содержащих наряду с двухэлектронными двухцентровыми
хим. связями В—В многоцентровые двух-электронные связи.
ромбоэдрич.
модификацию, в к-рую переходят и все остальные формы выше 1500°С. В интервале
1000-1500°С можно одновременно получить смесь разл. модификаций. Кристаллич.
решетки всех модификаций Б. построены из икосаэдров В12 - полиэдрич.
электронодефицитных структур, содержащих наряду с двухэлектронными двухцентровыми
хим. связями В—В многоцентровые двух-электронные связи.
Ниже приводятся св-ва р-ромбоэдрич. Б.: т. пл. 2074°С, т. кип. 3658°С;
С° 11,09Дж/(моль-К);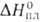 50,2 кДж/моль,
50,2 кДж/моль,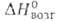 560кДж/моль (О К),
560кДж/моль (О К),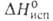 512кДж/моль; S°298 5,90 Дж/(моль*К) [для газа 153,2 ДжДмоль
• К)]; ур-ние температурной зависимости давления пара lg p (атм) = = 7,239-28,840/T(1781-2152
К); температурный коэф. линейного расширения (4,8-7,0)*10-6_К-1
(293-1300 К); теплопроводность при 300 К 2,6-10-3 Вт/(м*К);
дебаевская т-ра 1220 К;
512кДж/моль; S°298 5,90 Дж/(моль*К) [для газа 153,2 ДжДмоль
• К)]; ур-ние температурной зависимости давления пара lg p (атм) = = 7,239-28,840/T(1781-2152
К); температурный коэф. линейного расширения (4,8-7,0)*10-6_К-1
(293-1300 К); теплопроводность при 300 К 2,6-10-3 Вт/(м*К);
дебаевская т-ра 1220 К;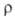 (0,7-4,0)*109 МОм*м (88 К), 105 МОм*м (200 К), 0,05
МОм*м (500 К). Б. - полупроводник р-типа; ширина запрещенной зоны по данным
электрич. и оптич. измерений соотв. 1,42 и 1,53 эВ; дырочная проводимость
55*104, электронная 104 м2/(В*с); постоянная
Холла 7*10-3 м3/Кл (298 К); концентрация собств.
носителей тока 5*1014(433 К) и 9*1019 м-3П073
К). Б. диамагнитен, магн. восприимчивость — 0,78*10-9 (298 К).
Для монокристаллов показатель преломления 3,44 (при длине волны
(0,7-4,0)*109 МОм*м (88 К), 105 МОм*м (200 К), 0,05
МОм*м (500 К). Б. - полупроводник р-типа; ширина запрещенной зоны по данным
электрич. и оптич. измерений соотв. 1,42 и 1,53 эВ; дырочная проводимость
55*104, электронная 104 м2/(В*с); постоянная
Холла 7*10-3 м3/Кл (298 К); концентрация собств.
носителей тока 5*1014(433 К) и 9*1019 м-3П073
К). Б. диамагнитен, магн. восприимчивость — 0,78*10-9 (298 К).
Для монокристаллов показатель преломления 3,44 (при длине волны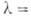 0,45мкм), коэф. поглощения 10-2 м-1 (при
0,45мкм), коэф. поглощения 10-2 м-1 (при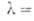 1,3-3,8 мкм).
1,3-3,8 мкм).
По твердости Б. занимает второе (после алмаза) место среди всех в-в:
твердость по Моосу 9,3, по Виккерсу 274,4 ГПа, по Кнупу 2460; микротвердость
30,4 ГПа. Модуль Юнга 282,2 ГПа (для борного волокна 411,6 ГПа);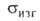 147 МПа (293 К), 882 МПа (1273 К) (для борного волокна 13,7 ГПа при 1330-1890
К); линейный коэф. сжимаемости 1,8*10-7 (303 К), объемный 3*10-7
(293 К). Б. очень хрупок, в пластич. состояние переходит выше 2000 °С.
147 МПа (293 К), 882 МПа (1273 К) (для борного волокна 13,7 ГПа при 1330-1890
К); линейный коэф. сжимаемости 1,8*10-7 (303 К), объемный 3*10-7
(293 К). Б. очень хрупок, в пластич. состояние переходит выше 2000 °С.
Химически Б. довольно инертен (особенно кристаллический). К-ты, не являющиеся
окислителями, с Б. не реагируют, конц. HNO3 и царская водка
окисляют его до борной кислоты
Н3ВО3. При
сплавлении со щелочами на воздухе либо при взаимод. с расплавл. Na2O2
или смесью KNO3 и Na2CO3 Б. образует бораты.
С Н2 он непосредственно не взаимод., бороводороды
получают
косвенным путем. Выше 1200°С Б. реагирует с N2 (а также с NH3),
давая бора нитрид
BN. В р-циях с F2 (ок. 20 °С), с С12
(ок. 400 °С), с Вг2 (ок. 600 °С), с 12 (ок. 700 °С)
образует тригалогениды ВНа13 (см. Бора трифторид
, Бора трихлорид)-бесцв.
дымящие
на воздухе летучие соед., к-рые легко гидролизуются водой, склонны к образованию
комплексных соед. типа Н[ВНа14]. Для трибромида ВВr3
т. пл. -46°С, т. кип. 89,8°С; плотн. 2,65 г/см3. Для трииодида
В13 т. пл. 49,8°С, т. кип. 210°С (с разл.); плотн. 3,3 г/см3.
Известны также низшие галогениды В2На14, В4На14,
В8На18, содержащие в молекуле связи В—В. Выше 500°С
Б. реагирует с газообразными HF и НС1 с выделением Н2.
С серой ок. 600°С, а также в атмосфере H2S или CS2
при 930°С Б. образует сульфид B2S3 (т. пл. 310°С;
плотн. 1,55 г/см3), с Se выше 700°С - селенид B2Se3,
с Р и As выше 900°С - соотв. фосфиды (ВР, В5Р) и арсениды (BAs,
B6As), отличающиеся высокой хим. и термин стойкостью.
ХАРАКТЕРИСТИКА КРИСТАЛЛИЧЕСКИХ МОДИФИКАЦИЙ БОРА
ВР и BAs (т. пл. выше 2000°С) - высокотемпературные полупроводники.
При взаимод. Б. (или В2О3) с С выше 2000°С получают
бора карбиды
В12С3 и В13С2,
с Si выше 1000°С - силициды B6Si (т. разл. 1864°С), B4Si
(т. разл. 1345°С), B3Si и В125i - кристаллич. в-ва,
не разлагаемые водой и р-рами щелочей и к-т; применяются как огнеупоры
и материалы регулирующих и защитных устройств ядерных реакторов. С большинством
металлов при высоких т-рах Б. образует бориды
.
Получение. Буру и кернит разлагают H2SO4
при 100°С, нерастворимый остаток отфильтровывают. Фильтрат охлаждают до
15 °С, при этом выпадают кристаллы Н3ВО3; к-ту обезвоживают
ок. 235°С с образованием В2О3. Аморфный Б. получают
восстановлением В2О3 магнием, Na, Са, Zn, К или Fe,
кристаллический - восстановлением галогенидов Б. (в осн. ВС13
или BF3) водородом или разложением галогенидов и гидридов Б.
(в осн. В2Н6) при 1000-1500°С. Б. получают также
электролизом расплава Na[BF4] или K[BF4] (образуются
при взаимод. соотв. NaOH или КОН либо солей Na или К с Н [BF4]),
чистый кристаллический (менее 0,05% примесей) - разложением ВВr3
на танталовой или вольфрамовой нити ок. 1300°С в присут. Н2
или разложением В2Н6 и В13 при 700-1000°С.
Высокой степени чистоты (10-3-10-4% примесей) достигают
зонной плавкой или вытягиванием монокристаллов из расплава.
Определение. Осн. метод выделения Б. из смеси - отгонка в виде
борнометилового эфира В(ОСН3)3 из кислых р-ров. Эфир
гидролизуют до Н3ВО3, к-рую титруют щелочью в присут.
маннита. Гравиметрически Б. определяют в виде Са(ВО,)2, образующегося
при взаимод. В(ОСН3)3 с Са(ОН)2, флуориметрически
- по фиолетово-синему окрашиванию с хинали зарином или диаминоантраруфином,
а также при помощи куркумина. Качественно Б. обнаруживают по буро-красному
окрашиванию куркумовой бумаги или по зеленому окрашиванию пламени при сгорании
В(ОСН3)3.
Применение. Б. - компонент коррозионностойких и жаропрочных сплавов,
напр. ферробора - сплава Fe с В (10-20%). Небольшая добавка Б. (1-3-10
%) значительно повышает мех. св-ва стали, сплавов цветных металлов и обусловливает
мелкозернистость их структуры. Б. насыщают пов-сть стальных изделий (борирование)
с целью улучшения их коррозионных и мех. св-в. Его используют в кач-ве
упрочнителя композиционных материалов (в виде волокон), как полупроводник
для изготовления терморезисторе в, счетчиков тепловых нейтронов, преобразователей
тепловой энергии в электрическую. Б. и его сплавы применяют также как нейтронопоглощающие
материалы для изготовления регулирующих стержней ядерных реакторов. Мировое
произ-во Б. (без СССР) в виде соединений 2,4 млн. т (1980). Ок. 50% получаемых
искусственных и прир. соед. Б. используют в произ-ве стекла, ок.. 30%-при
получении моющих ср-в, ок. 4-5%-для произ-ва эмалей, глазурей, гербицидов,
металлургич. флюсов.
Б. был открыт в 1808 Ж. Гей-Люссаком и Л. Тенаром и независимо от них-Г.
Дэви.
Лит.: Бор, его соединения и сплавы, под ред Г. В. Самсонова,
К., 1960; Немодрук А. А., Каралова 3. К., Аналитическая химия бора 5B10,811,
M., 1964; Цагарейшвили Г. В., ТавадзеФ. Н., Полупроводниковый бор. М..
1978. Н.Т.Кузнецов.

