ВРЕВСКОГО ЗАКОНЫ
, описывают зависимость состава равновесных жидкой
и паровой фаз двойных систем от т-ры (давления). Основываются на общих
термодинамич. соотношениях, устанавливающих условия равновесия в двухфазных
системах, частным случаем к-рых является равновесие жидкость - пар. При
выводе В. з. сделан ряд допущений, в частности предполагается, что поведение
газовой фазы близко к поведению идеального газа. Поэтому В.з. справедливы
только для области т-р и давлений, значительно удаленной от критич. точки
равновесия жидкость - пар в данной системе.
Первый В. з.: при данном составе жидкой фазы равновесная с ней газовая
фаза с увеличением т-ры (давления) обогащается тем компонентом, для к-рого
больше парциальная мольная теплота испарения. Приближенно вместо парциальной
мольной теплоты испарения данного компонента можно использовать теплоту
испарения чистого в-ва. Второй В.з.: в азеотропной смеси с максимумом на
изотерме зависимости общего давления от состава (минимумом на изобаре т-р
кипения) при повышении т-ры (давления) возрастает концентрация компонента
с большей парциальной мольной теплотой испарения. В азеотропной смеси с
минимумом общего давления (максимумом т-ры кипения) при повышении т-ры
(давления) возрастает концентрация компонента с меньшей парциальной мольной
теплотой испарения. Этот закон особенно важен при разработке процессов
азеотропной ректификации.
Третий В.з.: при изменении т-ры в системах, для к-рых на кривой зависимости
общего давления от состава имеется максимум (на кривой т-р кипения — минимум),
состав пара, находящегося в равновесии с р-ром постоянного состава, и состав
азеотропной смеси изменяются в одном направлении (вдоль линий АВ и
LM на рис. а); если же кривая общего давления имеет минимум (кривая т-р
кипения - максимум), то при изменении т-ры состав пара, находящегося в
равновесии с р-ром постоянного состава, и состав азеотропной смеси изменяются
в противоположных направлениях (вдоль линий АВ и LM на рис.
б).
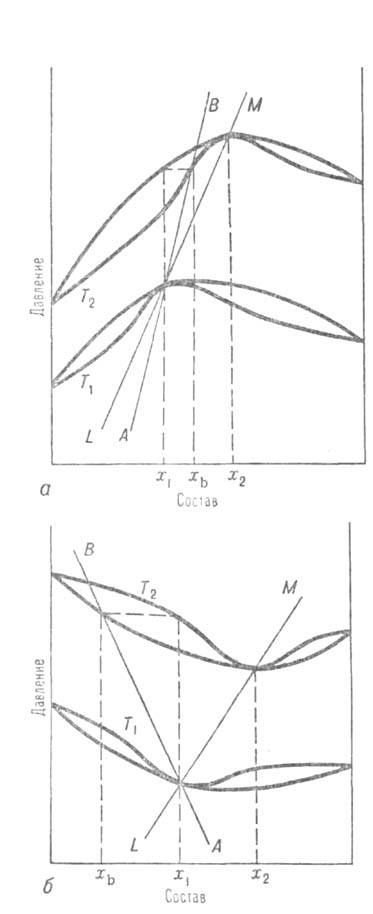
Диаграмма равновесия жидкость - пар для двойных систем с положит.
(а) и отрицат. (б) азеотропами; Т1 и Т2 - т-ры, х1
и х2 -составы, соответствующие азеотропным смесям, xb- состав пара при Т2, равновесного жилкой смеси состава x1.
Линия AВ-изменение состава пара с т-рой, линия LM - изменен не состава азеотропа с т-рой.
Законы были сформулированы М.С. Вревским в 1911 на основе эксперим.
исследований и широко используются при разработке процессов разделения
жидких смесей и очистки в-в.
Лит.: Вревский М.С, Работы по теории растворов. М.-Л., 1953;
Коган В. Б., Гетерогенные равновесия, Л., 1968, с. 114-26; Хазанова Н.
Е., Системы с азеотропизмом при высоких давлениях, М., 1978. Н. Е. Хазанова.

