ВИСМУТ
(нем. Wismut; лат. Bismuthum) Bi, хим. элемент V
гр. периодич. системы; ат. н. 83, ат. м. 208,9804. В природе один стабильный
изотоп 209Bi. Короткоживущие радиоактивные изотопы с мае. ч.
от 210 до 215 и периодами полураспада от 2 мин до 5 сут - члены прир. радиоактивных
рядов. Поперечное сечение захвата тепловых нейтронов для В. 3,4*10-30
м2. Конфигурация внеш. электронной оболочки 6s26p3;
степени окисления +3, +5 и — 3, очень редко + 1 и + 2; энергия (эВ) ионизации
при по-следоват. переходе от Bi° к Br5 + : 7,289,
16,74, 25,57, 45,3 и 56,0; сродство к электрону 0,7 эВ; электроотрицательность
по Полингу 1,9; атомный радиус 0,182 нм, ионные радиусы (в скобках указаны
координац. числа) 0,110 нм (5), 0,117 нм (6), 0,131 нм (8) для Bi3+
, 0,090 нм (6) для В15+ , 0,213 нм для Bi3-.
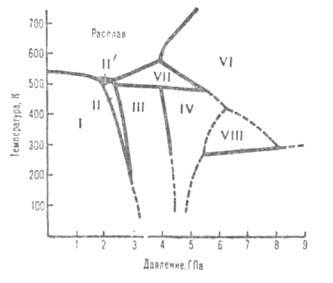
Диаграмма состояния висмута при высоких давлениях. Пунктирные линии-приблизительные границы областей существования фаз.
Содержание В. в земной коре 2*10-5 % по массе, в морской
воде - 2-10 5 мг/л. Важнейшие минералы - висмутин Bi2S3,
самородный Bi, козалит Pb2Bi2S5, тетрадимит
Bi2Te2S, бисмит Bi2O3, бисмутин
Bi2CO3 (ОН)4. Собственно висмутовые руды
редки. Обычно В. добывают из свинцовых, медных, оловянных, вольфрамовых
и др. руд.
Свойства. В.-серебристо-серый металл с розоватым оттенком. Имеет грубозернистое
строение. Может существовать в неск. кристаллич. модификациях (см. рис.,
табл.); при атм. давлении устойчива только модификация I, к-рая при 2,57
ГПа и 25 °С переходит в II, при 2,72 ГПа - в III, при 4,31 ГПа - в IV,
ок. 5 ГПа - в V, при 7,74 ГПа - в VI, при 30 ГПа - в IX.
ХАРАКТЕРИСТИКА НЕКОТОРЫХ КРИСТАЛЛИЧЕСКИХ МОДИФИКАЦИЙ ВИСМУТА

Для В. т. пл. 271,4 °С (модификация I), т. кип. 1564°С; плотн. 9,80
г/см3, жидкого 10,27 г/см3 (271 °С); Сop26,0
Дж/(моль *К);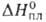 11,0 кДж/моль,
11,0 кДж/моль,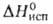 177,0 кДж/моль; So298 56,9 Дж/(моль*К); ур-ния температурной
зависимости давления пара: над твердым В. Igp(rHa) = 9,285 - 9725/T- 0,2401gT+
1,180Т, над жидким lg р (гПа) = 7,516 - 8929/T- 0,1171g T, температурный
коэф. линейного расширения 12,8*10-6 К-1 (283 К);
теплопроводность 8,41 Вт/(м*К) при 293 К;
177,0 кДж/моль; So298 56,9 Дж/(моль*К); ур-ния температурной
зависимости давления пара: над твердым В. Igp(rHa) = 9,285 - 9725/T- 0,2401gT+
1,180Т, над жидким lg р (гПа) = 7,516 - 8929/T- 0,1171g T, температурный
коэф. линейного расширения 12,8*10-6 К-1 (283 К);
теплопроводность 8,41 Вт/(м*К) при 293 К;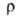 109*10-8 Ом*м, при т-ре плавления
109*10-8 Ом*м, при т-ре плавления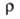 твердого В. 267*10-8 Ом*м, жидкого 127*10-8 Ом*м,
температурный коэф.
твердого В. 267*10-8 Ом*м, жидкого 127*10-8 Ом*м,
температурный коэф.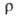 4,2*10-3
К-1 (273 К); т-ра перехода в сверхпроводящее состояние ~ 7 К;
стандартный электродный потенциал 0,2 В; диамагнитен, магн. восприимчивость
— 1,340*10-9. Твердость по Моосу 2,5, по Бринеллю 89 МПа;
4,2*10-3
К-1 (273 К); т-ра перехода в сверхпроводящее состояние ~ 7 К;
стандартный электродный потенциал 0,2 В; диамагнитен, магн. восприимчивость
— 1,340*10-9. Твердость по Моосу 2,5, по Бринеллю 89 МПа;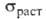 33,6 ГПа,
33,6 ГПа,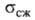 14,7 МПа. В. хрупок, но при 225-250°С может подвергаться пластич. деформации.
14,7 МПа. В. хрупок, но при 225-250°С может подвергаться пластич. деформации.
В сухом воздухе В. устойчив, во влажном постепенно покрывается буроватой
пленкой оксидов. Заметное окисление начинается ок. 500 °С. Выше 1000°С
В. горит голубоватым пламенем с образованием Bi2O3
(см. Висмута оксиды
). Не реагирует с Н2, С, N2,
Si. Жидкий В. незначительно растворяет фосфор. При сплавлении В. с серой
образуется Bi2S3, с Se и Те - соотв. селениды и теллуриды.
При нагр. он взаимод. с галогенами (см. Висмута галогениды
). С большинством
металлов при сплавлении образует интерметаллич. соед. - висмутиды, напр.
Na3Bi, Mg3Bi. He реагирует с соляной к-той и разб.
H2SO4. С азотной к-той образует нитрат, с конц. H2SO4
при нагр. - гидросульфат BiH(SO4)2. Соли В. легко
гидролизуются. Осаждение гидроксисолей В. начинается при рН ~ 1,6, полное
осаждение достигается при рН 4,8. Исключением являются перхлоратные р-ры
из-за высокой р-римости гидроксиперхлората Bi(OH)2ClO4.
В структуре гидроксосолей (устар. - соли висмутала) присутствуют октаэдрич.
ионы [Bi6O6]6+ , [Bi6O4(OH)4]6+
и [Bi6(он)12]6+.
Важнейшим соед. В. посвящены спец. статьи. Ниже приводятся сведения
о нек-рых других соед. этого элемента.
Нитрат существует в виде Bi(NO3)3*5H2O
- бесцв. кристаллы с т. пл. 75 °С и плотн. 2,8 г/см3. В воде
раств. инконгруэнтно с образованием осадка гидроксинитрата Bi(OH)2NO3.
Устойчив в разб. р-рах HNO3. Хорошо раств. в эфире и ацетоне.
Гидроксииитрат - бесцв. кристаллы с перламутровым блеском; при 400-450
°С разлагается до Bi2O3; не раств. в воде, легко
раств. в к-тах. Вяжущее и антисептич. ср-во.
Сульфат Bi2(SO4)3 - бесцв. кристаллы;
образует три-и гептагидраты. Так же, как гидросульфаты и гидроксисульфаты,
мало раств. в воде (не более 0,3% по массе в пересчете на Bi2O3);
выше ~ 400 °С разлагается с образованием оксисульфатов.
При сплавлении Bi2O3 и SiO2 образуются
ортосиликат Bi4(SiO4)3 (т. пл. 1020°С),
отвечающий по составу минералу эвлитину, и оксисиликат (силикосилленит)
Bi12SiO20 (т. пл. 880 °С). Эти соед. благодаря их
пьезоэлектрич. и электрооптич. св-вам применяют в радиоэлектронике. Они
м. б. синтезированы также гидротермальным путем из оксидов в р-рах щелочей.
Сесквиселенид Bi2Se3 и. сесквителлурид Bi2Te3
по
св-вам напоминают Bi2S3 (см. Висмута сульфиды
).
Кристаллизуются в ромбоэдрич. решетке (пространств. группа RЗm, z =
9). Для Вi2Se3 а = 0,418 нм, с = 2,87
нм; т. пл. 706 °С; плота. 7,66 г/см , ур-ние температурной зависимости
давления пара над твердым в-вом: 1gр(гПа) = 12,347 — 11890/Т, Нoобр—140
кДж/моль; теплопроводность 0,025 Вт/(см*К); ширина запрещенной зоны 0,35
эВ; коэф. термоэдс — 300 мВ/К; подвижность электронов 600см2
/(В*с).
Для Вi2Те3 а = 0,438нм, с = 3,04нм; т. пл. 586°С;
плота. 7,859 г/см3; ур-ние температурной зависимости давления
пара над твердым в-вом: 1др(гПа) = 11,175 —10443/T; С°р 124
Дж/(моль*К);
Нoобр—140
кДж/моль; теплопроводность 0,025 Вт/(см*К); ширина запрещенной зоны 0,35
эВ; коэф. термоэдс — 300 мВ/К; подвижность электронов 600см2
/(В*с).
Для Вi2Те3 а = 0,438нм, с = 3,04нм; т. пл. 586°С;
плота. 7,859 г/см3; ур-ние температурной зависимости давления
пара над твердым в-вом: 1др(гПа) = 11,175 —10443/T; С°р 124
Дж/(моль*К);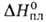 118,6 кДж/моль,
118,6 кДж/моль,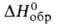 — 76,8 кДж/моль; So298 251 Дж/(моль*К); теплопроводность
0,0175 Вт/(см*К); ширина запрещенной зоны 0,15 эВ; коэф. термоэдс +230
мВ/К; подвижность электронов 1150 см2 /(В*с), подвижность дырок
440 см2 /(В*с).
— 76,8 кДж/моль; So298 251 Дж/(моль*К); теплопроводность
0,0175 Вт/(см*К); ширина запрещенной зоны 0,15 эВ; коэф. термоэдс +230
мВ/К; подвижность электронов 1150 см2 /(В*с), подвижность дырок
440 см2 /(В*с).
Получают Bi2Se3 и Bi2Te3
сплавлением элементов в кварцевом или графитовом тиглях в инертной атмосфере
или под слоем флюса. Иногда сесквителлурид и его сплавы с сесквиселенидом
производят горячим прессованием смеси порошков элементов с послед. отжигом.
Используют их как материалы термоэлектрич. генераторов. Известны также
низшие селениды и теллуриды общих ф-л ВiЭ2 (обладают широкими
областями однородности), Вi2Э и др. Все они плавятся инконгруэнтно.
Получение. Содержание В. в рудах обычно составляет десятые или
сотые доли процента (только для очень немногих месторождений - неск. %).
При переработке руд В. попадает в свинцовые, медные и др. концентраты.
Из этих концентратов получают ок. 90% всего добываемого В.
Осн. источник В. - свинцовые концентраты, получаемые при переработке
свинцовых, а также свинцово-цинковых и др. полиметаллич. руд. Они содержат
неск. сотых процента В., иногда - до 0,2%. При переработке этих концентратов
В. почти полностью попадает в черновой свинец, из к-рого удаляется при
его рафинировании. Обычно выделение В. из свинца производится действием
Mg и Са, при этом В. переходит в дроссы (поверхностные слои) в виде CaMg2Bi2.
Известен также способ отделения В. действием К и Mg. Иногда применяют электролитич.
рафинирование, при к-ром В. переходит в шламы.
Дроссы для удаления Са и Mg переплавляют под слоем щелочи с добавлением
окислителя (NaNO3). Обогащенный сплав обычно подвергают электролизу
в кремнефторидной ванне с получением шламов, к-рые далее переплавляют на
черновой В. Иногда для отделения Рb применяют обработку С12.
Предложен также электролиз в легкоплавких солевых расплавах с накоплением
В. в анодном расплаве вплоть до получения чернового В.
В медных концентратах содержание В. обычно составляет неск. тысячных
процента, лишь изредка - десятые доли. При их переработке В. концентрируется
в пылях плавильных печей и конвертеров, откуда его извлекают восстановительной
плавкой с содой и углем. Медно-висмутовые концентраты со сравнимым содержанием
этих элементов перерабатывают гидрометаллургич. путем. Выщелачивание производится
при ~ 105 °С соляной к-той или H2SO4 с добавлением
хлоридов металлов. В. выделяют из р-ров гидролитич. осаждением (рН ~ 2,5)
в виде окси- или гидроксихлоридов либо восстановлением железом в виде металла
(цементация). Для отделения В. от сопутствующих металлов м. б. использованы
экстракция и ионный обмен. Осадки оксихлорида переплавляют с добавлением
соды и угля: 4ВiOС1 + 2Na2CO3 + ЗС -> 4Bi + 4NaCl
+ 5СО2.
Собственно висмутовые концентраты (содержат обычно не более 3-5% В.
по массе, в редких случаях 30-60%) получают обогащением висмутовых руд
флотацией и др. способами. Перерабатывают концентраты путем восстановительной
плавки (после обжига или агломерации) либо осадительной плавки с добавлением
металлич. железа. Известны содовая плавка (4Bi2S3
+ 12Na2CO3 -> 8Bi + 9Na2S + 3Na2SO4
+ 12CO2), а также щелочная с NaOH.
Рафинирование В. заключается в последоват. обработке его расплава: серой
с добавлением угля (для удаления Fe и Си); щелочью с добавлением окислителя
или продувкой воздухом (для удаления As, Sb и Sn); цинком (для удаления
Аи и Ag); хлором (для удаления Рb и Zn). Применяют также электролитич.
рафинирование как в водных р-рах [В1С13, Bi2(SiF6)3],
так и в солевых расплавах. Для получения В. высокой чистоты используют
комбинацию разл. методов.
Определение. Качественно В. обнаруживают действием на его р-ры
CS(NH2)2, KCNS (в обоих случаях происходит желтое
окрашивание), цинхонина с KI (оранжевое), а также по ускорению восстановления
солей Рb2+ станнатом Na2SnO2 (черный осадок).
Количественно В. определяют: комплексонометрически в присут. пирокатехинового
фиолетового, ксиленолового оранжевого или др. индикаторов; фотометрически
с применением CS(NH2)2 или его производных (напр.,
о-толилтиокарбамида), дитизона, динафтилтиокарбазона и их производных.
Для отделения В. от сопутствующих элементов используют гидролитич. осаждение
в виде гидроксисолей. В. может быть осажден из р-ров также в виде фосфата
BiPO4*H2O, оксикарбоната (ВiO)2СО3*0,5Н2О,
гидроксихромата Bi(OH)CrO4 и др. Для отделения В. используют
также осаждение купфероном, тионалидом, 8-гидроксихинолином, экстракцию
аминами из солянокислого р-ра.
Применение. Металлич. В. - компонент легкоплавких сплавов, припоев,
баббитов и др., присадка к легко обрабатываемым сталям, др. сплавам, алюминию.
Сплавы В. с Мп применяют для изготовления мощных постоянных магнитов.
Мировое произ-во В. (без СССР) ок. 2600 т/год (1982). Осн. производители
- Австралия, Япония, Боливия, Перу. В. известен с 18 в. Его хим. индивидуальность
установлена в 1739 И. Потто м.
Лит.: Глембоцкий В. А., Соколов Е. С, Соложенкин П. М., Обогащение
висмутсодержащих руд, Душ., 1972; Металлургия висмута, А.-А., 1973; Самсонов
Г. В., Абдусалямова М. Н., Черногоренко В. Б., Висмутиды, К., 1977. П.И.Федоров.

