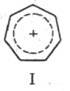
ТРОПИЛИЯ СОЕДИНЕНИЯ
(соли тропилия), содержат ион тропилия C7H7+
(ф-ла I). Тропилий (циклогептатриени-лий, T.) - ароматич. небензоидный карбкатион,
у к-рого заряд делокализован между всеми атомами С семичлен-ного цикла. Соли
T. C7H7+X- - стабильные, высокоплавкие
в-ва (напр., для хлорида, бромида, иодида т. пл. 102, 203 и 136 0C
соотв.); не раств. в неполярных орг. р-рителях; при X = Cl, Br, BF4,
SbF6 соед. хорошо раств. в воде и этаноле, при X = ClO4,
В(С6Н5)4, PtCl6 - плохо раств. в
этих р-рителях; хлорид и бромид гигроскопичны; перхлорат взрывает.
Для бромида потенциал восстановления
1,05 В; в УФ спектре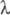 макс
275 нм (
макс
275 нм (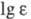 3,64);
в спектрах ЯМР 1H и 13C хим. сдвиги
3,64);
в спектрах ЯМР 1H и 13C хим. сдвиги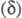 9,28 и 155 м. д. соотв.; pКа 4,75, pКа бензотропилия
1,6, дибензотропилия 3,7.
9,28 и 155 м. д. соотв.; pКа 4,75, pКа бензотропилия
1,6, дибензотропилия 3,7.
В водных р-рах солей T.
устанавливается равновесие между Т., тропиловым спиртом (нестабильное соед.)
и дитропило-вым эфиром (дитропилийоксидом):
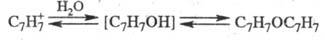
Соли T. легко реагируют
с нуклеоф. реагентами (RO-, H2S, NH3, RNH2
и др.), соединениями с подвижным атомом водорода (альдегиды, кетоны, 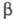 -кетоэфиры
и др.), активир. оле-финами и аренами, напр.:
-кетоэфиры
и др.), активир. оле-финами и аренами, напр.:
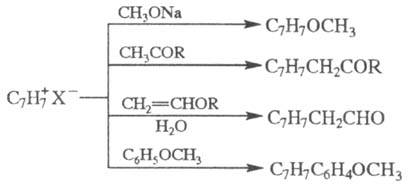
Р-ция T. с алленилсиланами
приводит к замещенным азу-ленам:
Соли T. легко окисляются
до бензальдегида (окислители -Br2, CrO3, Ag2O
и др.); при каталитич. гидрировании дают циклогептан, при восстановлении Zn
- дитропил (C7H7 )2.
Т.- эффективный акцептор
электронов; с ароматич. соединениями, галогенид-ионами и др. образует комплексы
с переносом заряда; возможен перенос одного электрона с образованием радикала
тропила C7H7 и перенос двух электронов от металлич. К
с образованием циклогептатриениланиона.
Ароматич. характер T. проявляется
в его высокой стабильности (энергия резонанса T. 83,7 кДж/моль). В отличие от
др. ароматич. соед., соли T. не вступают в р-ции с электроф. реагентами.
Под действием H2O2
тропилийбромид превращ. в бензол, при действии моногалогенкарбенов происходит
обратная р-ция: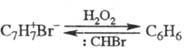
T. образует p-комплексы
с разл. металлами (Cr, Mo, Mn, Fe и др.), напр. [C7H7Fe(CO)3]+BF4-.
Описаны соединения Т.,
содержащие 2 или 3 иона T.
Препаративные методы синтеза
солей T. основаны на отщеплении гидрид-иона от циклогептатриена, напр.:
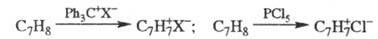
Впервые соль T. получена
У. Дёрингом [Дерингом] и Л. Ноксом в 1954 бромированием циклогептатриена с послед, отщеплением
HBr.
Лит.: Вольпин M.E.,
"Успехи химии", 1960, т. 29, в. 3, с. 298-363; Нозое Г., в кн.:
Небензоидные ароматические соединения, пер. с англ., M., 1963, с. 336-41; Губин
СП., Гол о унии А. В., Диены и их Новосиб., 1983, с. 33-134. И. С. Ахрем.
Новосиб., 1983, с. 33-134. И. С. Ахрем.
|

