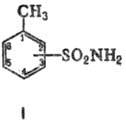
ТОЛУОЛСУЛЬФАМИДЫ
(амиды
толуолсульфокислот; ф-ла I), мол. м. 171,21. Различают 2-, 3- и 4-Т., соотв.
о-, Ми n-Т. Все Т.-бесцв. кристаллы; для о-Т.
т. пл. 158,2 °С, раств. в этаноле, ацетоне, р-римость в воде при 25
°С 0,17% по массе; для n-Т. т.пл. 137,5°С (безводный) и 105 °С
(Кристаллогидрат с 2 молекулами Н2О), раств. в этаноле, йодном р-рё [р-ре]
NaOH, р-римость в воде при 25 °С 0,31% по массе; для м-Т. т. пл.
108 °С.
Практич. значение имеют
орто- и пара-изомеры.
Т.-слабые к-ты (для n-Т.
рКа в воде 10,21); с орг. и неорг. основаниями образуют соли,
при этом соли 0-Т. хуже раств. в воде, чем соли n-Т., что используют
для разделения смеси изомеров. При действии сильных к-т (НС1, H2SO4)
Т. гидролизуются по связи S—N. С HNO3 незамещенные Т. образуют нитрамины,
с HNO2-толуол-сульфоновые к-ты, N-монозамещенные Т. дают N-нитрозо-производные;
N-нитрозо-N-метил-n-толуолсульфамид - полупродукт для получения диазометана:
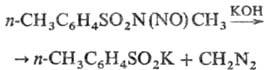
При взаимодействии n-Т.
с NaClO образуется хлорамин Т, а при действии избытка хлора на щелочной р-р
n-Т.-дихлорамин Т (см. Хлорамины
).
В присут. к-т или оснований
Т. присоединяются к изоцианатам с образованием толуолсульфонилмочевин; последние
получаются также при р-ции Т. с мочевинами:
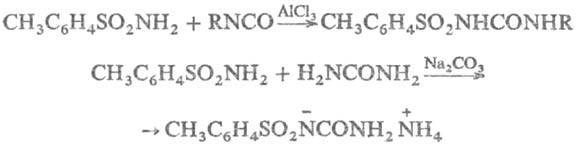
Взаимодействие Т. с сероуглеродом
с послед. действием СОСl2, SOCl2 или SO2Cl2
приводит к толуолсульфонил-изотиоцианатам, напр.:
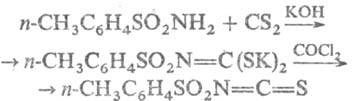
Т. конденсируются с альдегидами,
напр.:
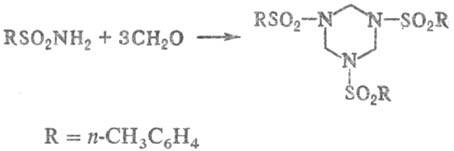
Продукты р-ции используют
для получения синтетических смол.
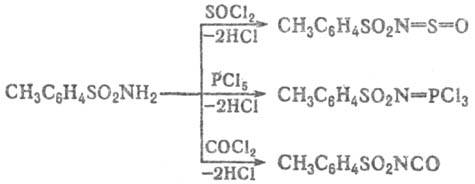
Ацилирование незамещенных
и N-монозамещенных Т. протекает по атому N и приводит в зависимости от ацилирующего
агента к толуолсульфонилсульфинила-минам, фосфазосоединениям, толуолсульфонилизоци-анатам
либо N-ацилзамещенным толуолсульфамидам, напр.:
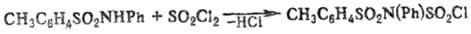
Взаимодействие n-Т.
с хлорантрахиноном- способ синтеза аминоантрахинона.
Восстановит. расщепление
Т. Zn в НСl, НВr или HI приводит к аминам и производным S(II); при каталитич.
гидрировании, а также действии LiAlH4 Т. не восстанавливаются, за
исключением N,N-дизамещенных соединений.
При окислении n-
T.
KМnО4 образуется л-карбоксибензол-сульфамид HOOCC6H4SO2NH2-полупродукт
для синтеза антисептич. св-ва пантоцида, при окислении о-Т.-имид
o-сульфобензоиной к-ты (сахарин).
Осн. метод получения Т.-взаимодействие
толуолсульфо-хлоридов с водным р-ром NH3 (незамещенные
Т.) либо с первичными или вторичными аминами (N-замещенные Т.); р-цию проводят
в воде в присут. акцепторов HCl[NaOH, СаСО3, (NH4)2CO3]
либо в среде орг. р-рителей-пиридина или избытка амина.
Незамещенные Т. образуются
при гидролизе толуолсуль-фонилизоцианатов либо при р-ции толуолсульфиновых к-т
с гидроксиламином:
CH3C6H4SO2NCO
+ Н2О : CH3C6H4SO2NH2
n-CH3C6H4SO2H
+ NH2OH : n-CH3C6H4SO2NH2
+ Н2О
N-Замещенные Т. получают
алкилированием (арилирова-нием) незамещенных Т. алкил- или арилгалогенидами
в щелочной среде, алкилсульфатами, алкилсульфонатами. Используют также перегруппировку
N-(n-толуолсульфонил) гидразобензола в присут. сильных к-т:
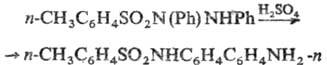
Т.-полупродукты для получения
полимерных материалов, реагенты в орг. синтезе. N-Алкилтолуолсульфамиды-пластификаторы
для эфиров целлюлозы.
Лит. см. при ст.
Толуолсульфохлориды
. Ю. Г. Шермолович.
|

