ТЕХНЕЦИЙ
(от греч.
technetos-искусственный; лат. Technetium) Тс, искусств. радиоактивный хим. элемент
VII гр. периодич. системы, ат. н. 43. Стабильных изотопов не имеет. Известно
16 изотопов и 6 ядерных изомеров с мае. ч. 92-107. Наиб. долгоживущие изотопы:
97Тс (T1/2 2,6·106 лет электронный захват),
98Тс (T1/2 1,5·106 лет,
b-распад) и 99Тс (T1/2 2,12·105
лет, b-распад). В природе встречается в ничтожных кол-вах в урановых рудах;
спектральные линии Т. обнаружены в спектрах Солнца и нек-рых звезд.
Конфигурация внеш. электронных
оболочек атома 4s24p64d55s2;
степени окисления от —1 до +7 (наиб. устойчива); электроотрицательность
по Полингу 1,36; атомный радиус 0,1358 нм, ионные радиусы Тс4+ 0,070
нм, Тс7+ 0,056 нм.
Свойства. Т.-серебристо-серый
металл с гексагон. решеткой, а = 0,2737 нм, с = 0,4391нм; т. пл. 2200
°С, т. кип. 4600°С; плотн. 11,487 г/см3; 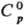 24 Дж/(моль · К);
24 Дж/(моль · К);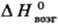 650 кДж/моль;
650 кДж/моль; 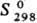 33 Дж/(моль · К); магн. восприимчивость
+ 2,7·10-4; сверхпроводник ниже 8,22 К.
33 Дж/(моль · К); магн. восприимчивость
+ 2,7·10-4; сверхпроводник ниже 8,22 К.
По хим. св-вам Т. близок
к Re. Стандартные электродные потенциалы для Tc(VI)/Tc(IV) 0,83 В, Tc(VII)/Tc(VI)
0,65 В, Tc(VII)/Tc(IV) 0,738В. Т. раств. в HNO3, конц. H2SO4
и царской водке. В водных р-рах может существовать в степенях окисления
от — 1 до + 7; наиб. устойчивы Tc(VII) и Tc(IV).
Оксид Тс2О7-светло-желтые
кристаллы; т. пл. 119,5°С, т. кип. 310,5 °С; ур-ние температурной зависимости
давления пара lgp (мм рт. ст.) = 18,279-7205/Т; хорошо раств.
в воде (с образованием технециевой к-ты НТсО4) и диоксане. Известны
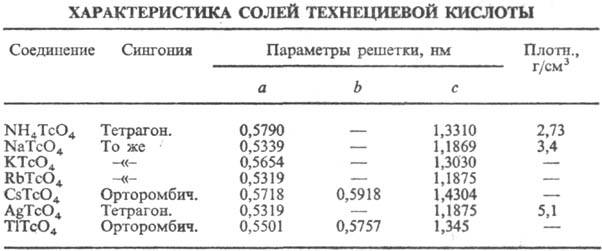
соли НТсО4-технетаты(VII) (см. табл.).
Диоксид ТсО2-твердое
зеленовато-черное в-во; плотн. 6,9 г/см3; устойчив на воздухе, окисляется
О2 до Тс2О7; образуется при электролизе, прокаливании
или восстановлении солей НТсО4.
Тетрахлорид ТсСl4-кроваво-красные
кристаллы; в конц. соляной к-те образует комплексный анион [ТсСl6]2-,
при взаимод. с О2-ТсО3Сl; получают при взаимод. Тс2О7
с ССl4 при 400 °С в автоклаве. Пентафторид TcF5-желтые
кристаллы с Орторомбич. решеткой (а = 0,76 нм, b = 0,58 нм, с = 1,66 нм); т. пл. 50 °С; получают при взаимод. Тс с F2.
Нагреванием Тс с избытком Сl2 или F2 при 400 °С получают
соответствующие гексагалогениды ТсНа16. Гексахлорид ТсСl6-твердое
темно-зеленое в-во; легко плавится с образованием зеленой жидкости. Гексафторид
TcF6-золотисто-желтое в-во; т. пл. 33,4 °С, т. кип. 55,3 °С;
при растворении в щелочных р-рах гидролизуется с образованием ТсО2 и
солей НТсО4.
Оксотрибромид ТсОВr3-коричневое
в-во, получают при взаимод. ТоО2 с парами Вr2 при 350°С;
оксотетраф-торид ТсОF4-голубые кристаллы (т.пл. 134°С), образуется
при взаимод. Тс с F2 в присут. О2; триоксохлорид ТсО3Сl
получен при взаимод. КТсО4 в H2SO4 с НС1; триоксофторид
ТсО3Р-желтые кристаллы (т.пл. 18,3°С, т. кип. 100 °С), гидролизуется
водой, образуется при пропускании F2 над ТсО2 при 150°С.
Известны галогенотехнетаты: NaTcF6 с ромбоэдрич. решеткой (а = 0,577 нм, a = 55,8 °); KTcF6 с ромбоэдрич. решеткой
(а = 0,497 нм, a = 97,0 °); К2ТсСl6-золотисто-желтые
кристаллы, получают восстановлением КТсО4 фосфорноватистой к-той
или I- в соляной к-те; К2ТсВr6-темно-красные
кристаллы, синтезируют упариванием К2ТсСlб с НВr; К2Тсlб-черные
кристаллы, получают упариванием К2ТсСl6 или К2ТсВr6
с HI; K2TcF6-розовые кристаллы, образуется при взаимод.
К2ТсСl6 или К2ТсВrб с расплавом
KHF2.
Дисульфид TcS2
восстанавливается Н2 или H2S при 1000 °С до металла.
Гептасульфид Tc2S7-темно-коричневое в-во, образуется при
пропускании H2S через кислые р-ры солей НТсО4.
Карбонил Тс2(СО)10-бесцв.
кристаллы, получают взаи-мод. Тс2О7 или ТсО2
с СО при 220-275 °С и давлении 25-40 МПа.
Известны.металлоорг. соединения
Т.: бис-(дициклопента-диенил)технеций [Тс(С5Н5)2]2-золотисто-желтые
кристаллы с т.пл. 155°С, получают р-цией ТсСl4 с циклопента-диенилнатрием;
пиклопентадиенилтрикарбонилтехнеций Тс(С5Н5)(СО)3-бесцв.
в-во с т.пл. 87,5°С.
Получение. Т. выделяют
из смеси продуктов деления 235 U-отходов атомной пром-сти, используя
ионный обмен, осаждение, экстракцию. С наиб. выходом-образуются 99Тс
(6,06%), 101Тс (5,6%), 102Тс (4,3%). В реакторе мощностью
2,8·105 кВт образуется 3 кг Т. ежегодно. Небольшие (миллиграммовые)
кол-ва Т., в т.ч. изотоп 99mТс, синтезируют путем длит. облучения
нейтронами Мо высокой чистоты. Металлич. Тс получают восстановлением его соед.,
напр. оксидов, водородом при 500-1000 °С или электрохимически. Мировое произ-во
Т. неск. тонн в год (1980).
Определение. Определению
Т. обычно предшествуют его концентрирование, выделение и очистка. Для количеств.
определения Т. чаще всего используют радиометрич., масс-спектрометрич., нейтронно-активационный
и спектрофото-метрич. методы. Уд. b-активность 99Тс составляет
37800 распадов/(мин · мкг), что позволяет определять ~ 10-7 г Т.
Чувствительность масс-спектрометрич. метода 5·10-9 г, а нейтронно-активационного
2·10 г. Спектрофотометрич. определение Т. проводят по линии поглощения Тс7+
(l 244 или 287 нм), чувствительность ~ 1 мкг/мл Т.
Соли НТсО4 ограниченно
используют как ингибиторы коррозии железа и малоуглеродистой стали, изотоп 99mТс
(Т1/2 6,015 ч, g-излучатель)-в диагностике опухолей головного
мозга, при исследовании центр. и периферич. гемодинамики. Для 96mTc,
99mTc группа радиац. опасности Г, миним. значимая активность (МЗА)
3,7·106 Бк; для :Тс, 97mТс, 97Тс
группа радиац. опасности В, МЗА 3,7·105 Бк.
Впервые Т. получили К.
Перье и Э. Сегре в 1937 при бомбардировке ядер Мо дейтронами.
Лит.: Спицын В.
И., Кузина А.Ф., Технеций, М., 1981; Зайцева Л. Л., Величко А. В., Виноградов
И. В., в кн.: Итоги науки и техники, сер. Неорганическая химия, в. 9, М., 1984.
Б.Ф. Мясоедов.
|

