ТЕРБИЙ
(от назв.
селения Иттербю, Ytterby, в Швеции; лат. Terbium) Tb, хим. элемент III гр. периодич.
системы, ат. н. 65, ат. м. 158,9254; относится к редкоземельным элементам (иттриевая подгруппа лантаноидов). В природе один стабильный изотоп 159Тb.
Конфигурация внеш. электронных оболочек 4f9 5s2
5p6 6s2; степени окисления +3,
+ 4, + 1; энергии ионизации при последоват. переходе от Тb0
к Тb5+ соотв. 5,85, 11,52, 21,91, 39,79, 66,5 эВ. Электроотрицательность
1,0-1,2; атомный радиус 0,177 нм, ионные радиусы, нм (в скобках даны координац.
числа): ТЪ3+ 0,106(6), 0,112(7), 0,118(8), 0,124(9), Тb4+
0,090(6), 0,102(8).
Содержание в земной коре
4,3·10-4% по массе, в морской воде ~ 10-7 мг/л. Вместе
с др. РЗЭ содержится в минералах ксенотиме, эвксените, монаците, бастнезите,
лопарите, гадо-лините и др.
Свойства. Т.-серебристо-белый
металл. Известны три модификации: a-Tb с гексагон. кристаллич. решеткой
типа Mg, а = 0,36010 нм, с = 0,56936 нм, z = 2, пространств.
группа P63/mmc, плотн. 8,272 г/см3; b-Tb
с кубич. решеткой типа a-Fe, а — 0,402 нм, z = 2, пространств.
группа Im3m, плотн. 8,12 г/см3; при давлении 1ГПа образуется
тригон. модификация типа Sm. а = 0,883 нм, a = 23,42°, z
= 3, пространств. группа 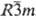 ;
т-ра полиморфного перехода a
;
т-ра полиморфного перехода a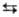 b
1287°С, DH перехода 5 кДж/моль; т. пл. 1357°С, т. кип.
3227 °С; 29Дж/(моль·К);,
b
1287°С, DH перехода 5 кДж/моль; т. пл. 1357°С, т. кип.
3227 °С; 29Дж/(моль·К);,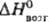 388
кДж/моль,
388
кДж/моль,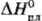 10,8
кДж/моль;
10,8
кДж/моль;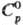
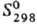 73,5 Дж/(моль·К); давление пара 10 кПа (1357°С);
температурный коэф. линейного расширения 1,18·10-5 К-1;
r 1,16·10-6 Ом·м; для a-Tb точка Кюри 219,6 К, точка Нееля
230,2 К; твердость по Бринеллю литого образца 677 МПа (20 °С). Легко поддается
механической обработке.
73,5 Дж/(моль·К); давление пара 10 кПа (1357°С);
температурный коэф. линейного расширения 1,18·10-5 К-1;
r 1,16·10-6 Ом·м; для a-Tb точка Кюри 219,6 К, точка Нееля
230,2 К; твердость по Бринеллю литого образца 677 МПа (20 °С). Легко поддается
механической обработке.
На воздухе компактный Т.
окисляется медленно, при нагр. во влажном воздухе-неск. быстрее. Реагирует с
минер. к-тами, медленно окисляется кипящей водой, взаимод. с галогенами, халькогенами,
N2, H2 при нагр., давая произвол" ные
Тb(III). Ион Тb3+ в водных средах весьма устойчив, имеет розовую
окраску, трудно окисляется и не восстанавливается. Тb+ известен только
в виде монохлорида TbCl (черные кристаллы тригональной сингонии, пространств,
группа 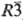 ), гидролизуется
водой. В водных р-рах Тb4+ существует лишь в виде малостабильных
гетерополиани-онов. В твердых фторидах и оксидах Tb(IV) существенно стабильнее.
), гидролизуется
водой. В водных р-рах Тb4+ существует лишь в виде малостабильных
гетерополиани-онов. В твердых фторидах и оксидах Tb(IV) существенно стабильнее.
Оксиды Т. - темно-коричневые
твердые в-ва. Наиб. устойчив нестехиометрич. оксид состава Тb4О7,
к-рый получают прокаливанием соединений Т. на воздухе при 800-1000 °С. Диоксид
ТbО2 (.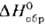 —
970,6 кДж/моль) образуется при давлении
О2 выше 15 МПа и т-ре ~ 300 °С, при обработке Тb4
О7 слабым р-ром СН3 СООН либо при кипячении TbF4
в щелочной среде; сесквиоксид Тb2О3 (т. пл. 2390
°С, — 1863,4 кДж/моль)-при разложении гидроксида или др.
—
970,6 кДж/моль) образуется при давлении
О2 выше 15 МПа и т-ре ~ 300 °С, при обработке Тb4
О7 слабым р-ром СН3 СООН либо при кипячении TbF4
в щелочной среде; сесквиоксид Тb2О3 (т. пл. 2390
°С, — 1863,4 кДж/моль)-при разложении гидроксида или др.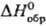 кислородсодержащих
соед. Тb(III).
кислородсодержащих
соед. Тb(III).
Тетрафторид TbF4-бесцв.
кристаллы моноклинной сингонии типа UF4; 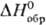 -1776
кДж/моль; ок. 550 °С разлагается
до TbIII(TbIVF5)3, выше 600°С-до
TbF3; получают взаимод. F2 или др. сильных фторирующих
агентов с TbF3 или Тb4О7 при 350-500°С.
Трифторид TbF3-бесцв. кристаллы ромбич. сингонии; плотн. 7,23 г/см3;
выше 950 °С существует гексагон. модификация; плотн. 7,50 г/см3;
т. пл. 1177°С;
-1776
кДж/моль; ок. 550 °С разлагается
до TbIII(TbIVF5)3, выше 600°С-до
TbF3; получают взаимод. F2 или др. сильных фторирующих
агентов с TbF3 или Тb4О7 при 350-500°С.
Трифторид TbF3-бесцв. кристаллы ромбич. сингонии; плотн. 7,23 г/см3;
выше 950 °С существует гексагон. модификация; плотн. 7,50 г/см3;
т. пл. 1177°С; 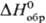 —
1700,8 кДж/моль; получают осаждением
из водных р-ров солей Tb(III) фтористоводородной к-той, р-цией Тb4О7
с HF, F2 при 400-500 °С и др. способами; применяют для металлотермич.
получения Т.
—
1700,8 кДж/моль; получают осаждением
из водных р-ров солей Tb(III) фтористоводородной к-той, р-цией Тb4О7
с HF, F2 при 400-500 °С и др. способами; применяют для металлотермич.
получения Т.
Трихлорид ТbСl3-бесцв.
кристаллы с ромбич. решеткой; выше 510°С существует моноклинная модификация;
т. пл. 582 °С, т. кип. 1552 °С; 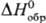 -998,7
кДж/моль; образует
гидраты; получают взаимод. смеси Сl2 и ССl4 с оксидом
или оксалатом Tb(III) выше 200 °С, обработкой SOCl2 гидрата ТbСl3
при кипячении с послед. перегонкой; применяют для металлотермического получения
Т., а также его соединений.
-998,7
кДж/моль; образует
гидраты; получают взаимод. смеси Сl2 и ССl4 с оксидом
или оксалатом Tb(III) выше 200 °С, обработкой SOCl2 гидрата ТbСl3
при кипячении с послед. перегонкой; применяют для металлотермического получения
Т., а также его соединений.
Получение. Выделяют
Т. из смеси РЗЭ методами экстракции и хроматографии, очищают, как правило, хроматогра-фически.
Металлический Т. получают металлотермич. восстановлением ТbСl3 или
TbF3.
Т. используют в качестве
активатора люминофоров (зеленое свечение) для телевизионных экранов, люминесцентных
ртутных ламп, рентгеновских аппаратов; перспективен для изготовления магн. материалов.
Нестехиометрич. оксиды (Тb4О7)-катализаторы, напр. окисления
Н2 и N2O. Известно применение также в магн. сплавах.
Тербий впервые выделен
в 1834 К. Мосандером из концентрата Y2O3. Л. И. Мартыненко,
С. Д. Моисеев, Ю.М. Киселев.
|

