СЕРЫ ГАЛОГЕНИДЫ
, газы
либо легколетучие жидкости с резким запахом (см. табл.). Все фториды, кроме
серы гексафторида
, легко гидролизуются водой и ее парами. Осн. метод
их получения - взаимод. F2 с жидкой или парообразной S, реже-с суспензией
или р-рами S в инертных р-рителях с послед. разделением смеси. Тетрафторид SF4
устойчив до 700 °С, выше 300 °С окисляется О2 до SOF4,
в присут. катализаторов с F2 дает SF6; раств. в жидком
HF и бензоле; получают взаимод. F2 с хлоридами S в присут. катализаторов,
а также смеси Сl2 и HF с S или ее хлоридами. Дитиодекафторид S2F10
при нагр. разлагается до SF4 и SF6. Дитиодифторид S2F2
существует в виде двух изомеров: FSSF и SSF2; при нагр. разлагается
до SF4 и S; получают взаимод. фторидов металлов с S или хлоридами
S.
Хлоропентафторид SClF5
при 200-300°С разлагается с выделением SF6 и С12;
получают взаимод. хлоридов S с HF, гидрофторидами орг. оснований, р-цией SF4
с Сl2.
Дитиодихлорид C1SSC1: пром.
продукт зеленовато-желтоватого цвета, бывает также желтого цвета (с примесью
S) и красного (с примесью SCl2); ок. 137°С разлагается на S и
Сl2; водой гидролизуется до SO2, H2S, HCl,
взаимод. к-рых приводит к образованию S и политионовых к-т; раств. до 66% по
массе S, хорошо раств. в этаноле, бензоле, диэтиловом эфире, CS2;
с оксидами и сульфидами мн. металлов образует хлориды и S, с сульфатами-SO2
Cl2, хлориды металлов, S, с SbCl3, HgCl2 и
др.-аддукты; получают взаимод. S с С12 при 130°С (очищают перегонкой),
как побочный продукт при произ-ве СНСl3, промежут. продукт в произ-ве
нек-рых инсектицидов. S2Cl2- первый член ряда дихлорсульфанов
8nСl2 (n достигает 100), при n —
3-8
SnСl2-оранжевые маслянистые жидкости;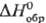 ,
кДж/моль: -51,9 (n
= 3), -42,7 (4), -36,8 (5), -29,3 (6), -22, 2 (7), -14,7 (8); плотн., г/см3:
1,7441 (п = 3), 1,7774 (4), 1,8018 (5), 1,8219 (6), 1,84 (7), 1,85 (8);
получают SnСl2 при нагр. S2Cl2
в токе Н2 либо S2 С12 с Н2 S и (или)
Н2 SB.
,
кДж/моль: -51,9 (n
= 3), -42,7 (4), -36,8 (5), -29,3 (6), -22, 2 (7), -14,7 (8); плотн., г/см3:
1,7441 (п = 3), 1,7774 (4), 1,8018 (5), 1,8219 (6), 1,84 (7), 1,85 (8);
получают SnСl2 при нагр. S2Cl2
в токе Н2 либо S2 С12 с Н2 S и (или)
Н2 SB.
При действии С12
на S2C12 получают дихлорид SC12, а при дальнейшем
хлорировании-тетрахлорид SC14-бесцв. или бледно-желтые кристаллы
при — 35 °С, т. пл. — 31°С; ок. — 15°С разлагается; 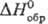 —56,1 кДж/моль; водой
гидролизуется до SO2 и НС1.
—56,1 кДж/моль; водой
гидролизуется до SO2 и НС1.
Дитиодибромид S2Вr2
разлагается ок. 90°С;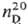 2,6288; получают при нагр. S с Вr2; гидролизуется водой. Получены
также малоустойчивые дибромсульфаны SnВr2.
2,6288; получают при нагр. S с Вr2; гидролизуется водой. Получены
также малоустойчивые дибромсульфаны SnВr2.
Применяют SF4
для селективного замещения карбонильного О на F2, для получения SF6;
S2Cl2-вулканизующий агент, его используют для синтеза
хлоридов, в произ-ве инсектицидов; S2C12 и SC12-применяют
для хлорирования, в произ-ве добавок к высокоустойчивым смазочным маслам, 8Сl2-для
получения SF4.
С г. токсичны, поражают
слизистые оболочки, дыхат. пути; ПДК 0,5 мг/м3 (SF4, S2F10),
0,3 мг/м3 (S2Cl2) в воздухе рабочей зоны, 0,01
мг/м3 в атм. воздухе.
См. также Сульфурилгалогениды
,
Тионилгалогениды
.
И.Н. Один.
|

