РАДИКАЛЫ СВОБОДНЫЕ
, хим.
частицы с неспаренными электронами на внеш. орбиталях; обладают парамагнетизмом
и высокой реакц. способностью.
Р. с. могут быть короткоживущими
(время жизни доли секунды) или долгоживущими (до неск. лет), нейтральными или
заряженными (см. Ион-радикалы
), иметь один или большее число неспаренцых
электронов (напр., бирадикалы
), быть твердыми, жидкими или газообразными
в-вами. Стабильность Р. с. определяется скоростями их рекомбинации или диспропорционирования.
Все радикалы условно делят
на две группы -p- и s-элект-ронные. У первых неспаренный электрон
преим. локализован на 2p- или p-орбитали, а соответствующие атомные
ядра находятся в узловой плоскости этой орбитали. К p-элект-ронным относятся
алкильные, аллильный и бензильный радикалы, а также ион-радикалы ароматич. углеводородов,
циклооктатетраена, дивинила и подобных частиц, напр.:
[(CH3)2NC6H4NH2]+;
[(NC)2C=C(CN)2]-:
У s-электронных Р.
с. неспаренный электрон преим. локализован на s-орбитали таким образом,
что радикал практически сохраняет электронную конфигурацию исходной молекулы.
К таким Р. с. относят фенильный, ванильный и формильный радикалы, а также карбоксильный
и пиридильный ион-радикалы
(соотв.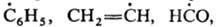
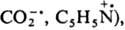 к-рые имеют плоскую конфигурацию. В эту же группу Р. с. входят многочисл. хим.
частицы с пирамидальным парамагнитным центром (напр.,
к-рые имеют плоскую конфигурацию. В эту же группу Р. с. входят многочисл. хим.
частицы с пирамидальным парамагнитным центром (напр.,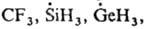
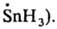
Короткоживущие Р. с. К
таким радикалам относятся атомы и сложные хим. частицы с локализованными неспаренными
электронами (своб. валентностями), напр.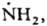
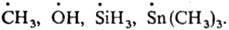 Для стабилизации таких Р. с. используют низкие т-ры, применяя в качестве хладагентов
жидкие Не, Н2, N2 или Аr. В застеклованных инертных р-рителях
при низких т-рах Р. с. стабилизируются, находясь в
т. наз. замороженном состоянии (см. также Клетки эффект
). В разл. твердых
прир. и синтетич. материалах (напр., в орг. и неорг. стеклах) Р. с. стабилизируются
в результате уменьшения диффузионной подвижности.
Для стабилизации таких Р. с. используют низкие т-ры, применяя в качестве хладагентов
жидкие Не, Н2, N2 или Аr. В застеклованных инертных р-рителях
при низких т-рах Р. с. стабилизируются, находясь в
т. наз. замороженном состоянии (см. также Клетки эффект
). В разл. твердых
прир. и синтетич. материалах (напр., в орг. и неорг. стеклах) Р. с. стабилизируются
в результате уменьшения диффузионной подвижности.
Для генерирования короткоживущих
Р. с. используют разл. физ. и хим. методы воздействия на в-во, напр. фотолиз,
радиолиз, пиролиз, электролиз.
Образование Р. с. при электролизе
может осуществляться в условиях Кольбе реакции
, напр.:
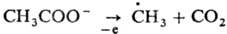
При фотолизе энергия светового
кванта, поглощаемого в-вом, должна быть равной или превышать энергию диссоциации
(Eд) хим. связи молекулы, напр.:
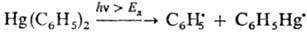
В условиях импульсного фотолиза
генерируют короткожи-вущие Р. с., выход к-рых может достигать 100%.
Легкость термин, распада
молекул на Р. с. также зависит от энергии диссоциации соответствующей хим. связи.
В качестве источников нестабильных Р. с. часто используют орг. пероксиды, напр.
бензоилпероксид, трет
-бутилгидроперок-сид, кумилпероксид, трет
-бутилпероксид
(см. Инициаторы радикальные
). Последний, напр., удобен для генерирования
Р. с. в р-рах при умеренных т-рах:
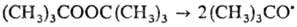
mpem-Бутоксильные
радикалы легко осуществляют отрыв атома Н от молекул углеводородов, поскольку
связь О—Н в mpem-бутаноле прочнее связи С—Н:
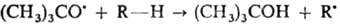
Сольватация Р. с. в р-рах
обычно изменяет их электронное строение, геометрию и реакц. способность. Нек-рые
Р. с. могут существовать только в р-рах, находясь в термодина-мич. равновесии
с молекулами. Напр., при растворении в воде соли Фреми образуется темно-фиолетовый
р-р гидратир. анион-радикала 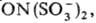 св-ва к-рого на воздухе
при 25°С практически не изменяются в течение мн. часов.
св-ва к-рого на воздухе
при 25°С практически не изменяются в течение мн. часов.
Пример мол.-индуцир. генерирования
Р. с.-спонтанная полимеризациястирола:
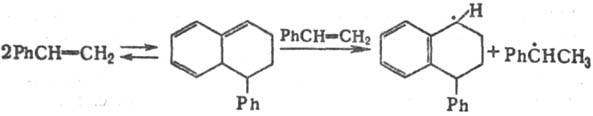
Долгоживущие Р. с. Такие
радикалы обладают сильно делокализованными неспаренными электронами и обычно
стерически экранированными реакц. центрами.
Очищенные образцы нек-рых
арилметильных радикалов представляют собой устойчивые на воздухе при 25 °С
ярко окрашенные кристаллы или аморфные в-ва с содержанием неспаренных электронов
ок. 6-10 спин/моль (показатель, характеризующий содержание парамагнитных частиц).
Уникальной термостабильностью и хим. стойкостью обладают 1,3-бис-(бифенилен)-2-(4-изопропилфенил)
аллил - кристаллы ярко-зеленого цвета (т. пл. 189°С) ,и т. наз. инертные
радикалы, напр. (С6С15)2СС1, (С6С15)3С,
(С6С15)2СС6С14ОН-высокоплавкие
в-ва оранжево-красного цвета.
Р. с. этого типа образуют
сольватные комплексы, к-рые существуют в р-рах в термодинамич. равновесии с
молеку-лами-димерами. Таким образом ведут себя трифенилметил и его многочисл.
аналоги (см. табл.). Для сложных сопряженных систем на состояние равновесия
в р-рах между Р. с. и их димерами, кроме сольватац. факторов, оказывают влияние
мезомерные и стерич. эффекты.

Ароксильные радикалы
представляют собой интермедиаты окисления фенолов. Известны лишь единичные
примеры высокоочищенных
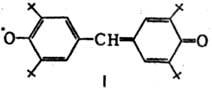
в-в этого типа, напр. гальвиноксильный радикал
(ф-ла I; т. пл. 158°С)
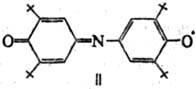
и индофеноксил (II; т. пл. 136°С).
Ароксильные Р. с. лишь
условно можно назвать долгоживу-щими, т. к. в норм. условиях они быстро реагируют
с кислородом, и поэтому операции с такими в-вами обычно проводят в инертной
атмосфере или с использованием вакуумной техники.
Устойчивые на воздухе при
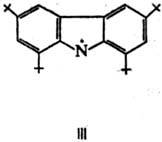
25 °С Р. с. аминильного ряда обычно получают путем окисления вторичных аминов.
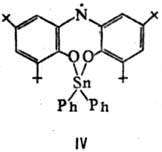
Известны, напр., темно-синие., кристаллы 1,3,6,8-тетра-трет
-бутил-9-карбазила
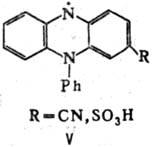
(III; т. пл. 145°С) и соед. IV (т. пл. 216 °С), а также вишнево-красные
замещенные феназиниль-ные Р. с. (V).
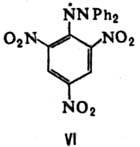
Долгоживущие гидразильные радикалы представляют собой устойчивые на воздухе интенсивно окрашенные
кристаллы. Типичное в-во этой группы - N,N--дифенил-N-пикрил-гидразильный радикал (VI; фиолетовые кристаллы, т. пл. 137-138 °С).
Выраженная тенденция Р.
с. этой группы к сольватации создает трудности при получении очищенных образцов
этих в-в с постоянными физ.-хим. характеристиками.
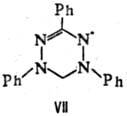
Вердазильные радикалы
относятся к числу наиб. стабильных орг. парамагнетиков. Периоды полупревращения
нек-рых из них на воздухе при 25 °С составляют мн. годы. Характерный представитель
этой группы Р. с.- 1,3,5-три-фенилвердазил (VII; темно-зеленые кристаллы, т.
пл. 143 °С).
Нитроксильные радикалы
традиционно наз. азотокисями или нитроксидами из-за их формального сходства
с тривиальными оксидами аминов. Представитель этой группы-т. наз. порфирексид
представляет собой р-римые в воде кир-пично-красные кристаллы; его строение
м. б. представлено суперпозицией неск. валентно-таутомерных структур, напр.:
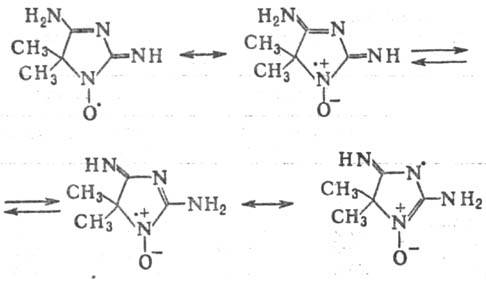
Выраженная делокализация
неспаренного электрона (тер-модинамич. фактор) и стерич. экранирование реакц.
центров (кинетич. фактор) объясняют стабильность в норм. условиях мн. нитроксильных
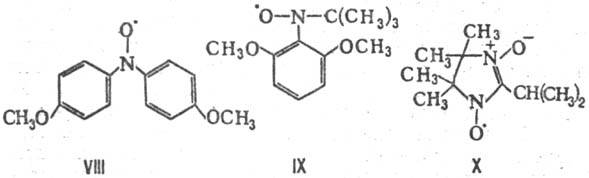
Р. с. ароматич., жирно-ароматич. и гете-роциклич. типа таких, напр., как 4,4-диметоксидифенилнит-роксил
(VIII; т. пл. 161 °С), 2,6-диметоксифенил-трет
-бу-тилнитроксил (IX;
т. пл. 102°С) и нитроксиднитроксильный радикал имидазолинового ряда (X;
т. пл. 100 °С).
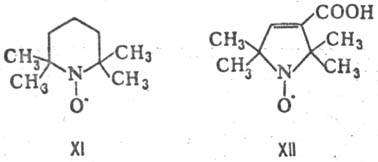
Нек-рые нитроксильные Р.
с. несмотря на наличие сильно локализованного неспаренного электрона исключительно
стабильны на воздухе, напр. темно-красный 2,2,6,6-тетра-метилпиперидин-1-оксил
(XI; т. пл. 38 °С) и желтый 2,2,5,5-тетраметил-3-карбоксипирролин-1-оксил
(XII; т. пл. 211 °С).
Иминоксильные радикалы
(алкилидениминоксильные радикалы) представляют собой частицы общей ф-лы
 напр. ди-трет
-бутилметилениминоксил
напр. ди-трет
-бутилметилениминоксил
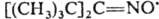 (жидкость
бирюзового цвета; т. пл. —21 °С,
(жидкость
бирюзового цвета; т. пл. —21 °С, 1,4452). Радикалы этого типа могут существовать в виде двух изомеров -син
и анти
:
1,4452). Радикалы этого типа могут существовать в виде двух изомеров -син
и анти
:
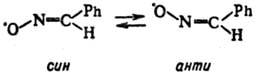
Синтез долгоживущих Р.
с. осуществляют разнообразными методами, включая одноэлектронные окислит.-восстано-вит.
и региоселективные р-ции без затрагивания парамагнитного центра (подробнее см. статьи об отдельных группах долгоживущих Р. а). Т. обр., напр., получают спин-меченые
реагенты, высокомол. радикалы и др.
Реакционная способность
Р. с. Определяется гл. обр. наличием своб. валентности, благодаря к-рой они
могут вступать в р-ции радикального замещения, присоединения, распада, изомеризации,
рекомбинации и диспропорционирования (см. Радикальные реакции
).
Необычными являются нерадикальные
региоселективные р-ции, в к-рых неспаренные электроны не участвуют в образовании
новых хим. связей (р-ции без затрагивания парамагнитного
центра). Такие р-ции особенно характерны для нитроксильных радикалов.
Методы обнаружения и анализа.
Осн. специфич. методы обнаружения и исследования строения Р. с. основаны на
использовании спектроскопии электронного парамагнитного резонанса
. Спектры
ЭПР дают информацию о хим. строении Р. с., степени делокализации неспаренного
электрона, о распределении спиновой плотности по разл. атомам частицы. Методом
ЭПР можно обнаружить радикалы в концентрации 10-9 моль/л.
Для изучения структур сложных
Р. с. используют метод двойного электрон-ядерного резонанса (ДЭЯР). Р-ры с высокими
концентрациями Р. с. могут быть исследованы с использованием спектров ЯМР (особенно
когда константы сверхтонкого взаимод. в спектрах ЭПР малы). Для изучения гомолитич.
распада молекул в р-рах, взаимод. радикальных пар и др. используют метод химической поляризации ядер
Для идентификации и исследования
Р. с. используют также спектры в видимой и ультрафиолетовой областях, ИК спектры
и спектры комбинац. рассеяния (часто в сочетании с импульсным фотолизом), а
также масс-спсктрометрию.
Хим. методы исследования
широко используют для определения долгоживущих Р. с. В качестве хим. индикаторов
короткоживущих Р. с. можно использовать мономеры (напр., стирол), к-рые в присутствии
парамагнитных частиц полимеризуются (метод Циглера).
Для идентификации и исследований
короткоживущих Р. с. их превращают в долгоживущие (обычно в нитроксильные) при
взаимод. парамагнитных частиц, напр., с нитронами или нитрозосоед. (т. наз.
спиновых ловушек метод
).
Короткоживущие Р. с.  можно определять с
помощью C(NO2)4, к-рый при взаимод. с ними превращ. в
нитроформ CH(NO2)3, существующий в водных р-рах в виде
интенсивно окрашенного аниона. Последний количественно определяется колориметрич.
методами.
можно определять с
помощью C(NO2)4, к-рый при взаимод. с ними превращ. в
нитроформ CH(NO2)3, существующий в водных р-рах в виде
интенсивно окрашенного аниона. Последний количественно определяется колориметрич.
методами.
Применение, нахождение
в природе. Долгоживущие Р. с. (гл. обр. нитроксильные) находят широкое применение
в качестве ингибиторов полимеризации и окисления разл. орг. материалов, напр.
для стабилизации акрилонитрила, винил-ацетата, винилиденхлорида, стирола, фурфурола,
СК и НК, жиров и масел. Их применяют также в молекулярно-биол. исследованиях
в качестве спиновых меток и зондов (см. Липидные зонды
, Спинового зонда метод
),
в судебно-мед. диагностике, аналит. химии, для повышения адгезии полимерных
покрытий, при изготовлении фотоматериалов, в приборостроении, в геофизике и
дефектоскопии твердых тел, напр. алмазов. Короткоживущие Р. с.-промежут. частицы,
во мн. орг. р-циях (радикальное галогенирование и др.).
Контролируемое ферментами
образование Р. с. в живых организмах происходит и в процессах нормальной жизнедеятельности,
напр. при биосинтезе простагландинов, транспорте электронов в митохондриях,
обезвреживании бактерий фагоцитирующими клетками. Образованием в организме активных
Р. с. объясняют процессы старения. Различные Р. с. обнаружены в космосе.
Существование Р. с. постулировалось
в 19 в. Первый долгоживущий Р. с. [трифенилметил (С6Н5)3С•]
обнаружен в р-ре в 1900 М. Гомбергом. В 1901 О. Пилоти и Б. Шверин получили
нитроксильный радикал гетероциклич. природы порфирексид, но не идентифицировали
его как Р. с. В 1911-22 Г. Виландом разработана химия ароматич. нитроксильных
радикалов и диариламинильных радикалов.
Впервые алкильные радикалы
(СН3 и СН3СН2) идентифицированы в 1929 Ф. Пакетом.
В последующие годы развитие химии Р. с. было связано с открытием и использованием
для идентификации радикалов метода ЭПР, а также с синтезом разл. групп долгоживущих
Р. с.
Лит.: Бучаченко
А. Л., Вассерман А. М., Стабильные радикалы, М., 1973; Вертц Дж., Болтон Дж.,
Теория и практические приложения метода ЭПР, пер. с англ., М., 1975; Походенко
В. Д., Белодед А.А., Кошсч-ко В. Д., Окислительно-восстановительные реакции
свободных радикалов, К., 1977; Розанцев Э. Г., Шолле В. Д., Органическая химия
свободных радикалов, М., 1979; Нонхибел Д., Теддер Дж., Уолтов Дж., Радикалы,
пер. с англ., М.,
1982; Нитроксильные радикалы. Синтез, химия, приложения, под ред. Э. Г. Розанцева
и Р. И. Жданова, М., 1987; Kaiser E., Kevan L., Radical ions, N. Y., 1968; Kochi
J. K. (ed.), Free radicals, v. 1-2-4, N.Y., 1973-80; Polymer stabilization and
degradation, Wash., 1985; Landolt - Bornstein, New Scries. Numerical data and
functional relationships in science and technology. Group II, v. 9, 13, 17,
В. 1977-1988. Э.Г. Розанцев.
|

