ПИНАКОЛИНОВАЯ И РЕТРОПИНАКОЛИНОВАЯ ПЕРЕГРУППИРОВКИ
, взаимные превращ. 1,2-диолов и
карбонильных соед.- альдегидов и кетонов, сопровождающиеся 1,2-миграцией заместителей
- атома H или групп атомов.

R, R1, R3
-H. алкил, арил, R2-H, алкил, арил, аралкил, ацил. Пинаколиновая
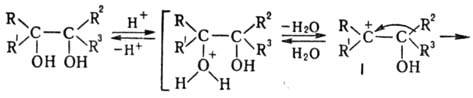
перегруппировка (П.п.)-превращение гл. обр. третичных диолов (пинаконов) в кетоны
(пинаколины) под действием электроф. реагентов (к-т, их ангидридов и галогенангидридов,
ZnCl2 и др.). Отщепление гидроксильной группы вызывает смещение одного
из заместителей (R2) к возникающему карбениевому центру; при этом
карбкатион I превращ. в более стабильный карбоксо-ниевый катион II, к-рый затем
отщепляет H+ и переходит в карбонильное соед.:
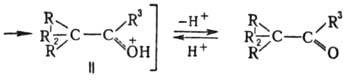
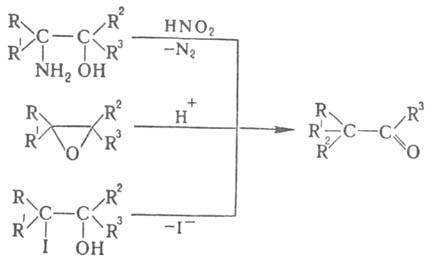
К П. п. относят также превращения
вторичных диолов, 1,2-аминоспиртов (пинаколиновое дезаминирование, см. Тиффено реакция
), оксиранов, 1,2-галогенгидринов, напр.:
Строение продуктов П. п.
определяется способностью заместителей стабилизировать промежут. катионы, стерич.
факторами, подвижностью (способностью к миграции) заместителей и условиями среды.
Преим. мигрирует группа в перипланарном положении к уходящей группе. П. п. обычно
протекают с обращением конфигурации в конечном пункте миграции; в ациклич. системах
наблюдается частичная рацемизация; конфигурация мигранта не меняется. В целом
стереоселективность П. п. уменьшается с ростом стабильности катионоидных интермедиатов
(увеличение вероятности поворота карбениевого центра вокруг С—С связи). П. п.
используют для синтеза разл. кетонов, а также соед. со спирановой структурой,
напр.:
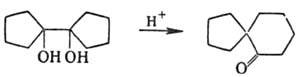
П.п. открыл A.M. Бутлеров
в 1873.
При ретропинаколиновых
перегруппировках (P. п.)-превращениях a-разветвленных альдегидов и кетонов
в 1,2-диолы и их производные - происходит миграция одного из a-заместителей
R к атому С карбонильной группы. P. п. возможны, когда термодинамич. стабильность
карбо-ксониевого иона II близка к стабильности третичных карбкатионов I, что
м. б. достигнуто, напр., при замене группы ОН на более сильный акцептор электронов
- ацило-ксигруппу. P. п. происходят в результате О-ацилирования альдегидов и
кетонов аддуктами ацилхлоридов с к-тами Льюиса в апротонной среде, а также при
ионизации a-хлоралкилацилатов III:

При P. п. 1,3-дикетонов
(IV; R2 = ацил, R3 = алкил) и 1,3-кетоальдегидов (IV;
R2 = ацил, R3 = H) мигрирует ацил и
образуются 2,3-дигидроксикетоны (V; R2 = ацил), т. е. простейшие
моносахариды-триозы. Пример P. p-изомеризация пинаколина при действии SO3,
а также при его протонировании в среде бензонитрила:
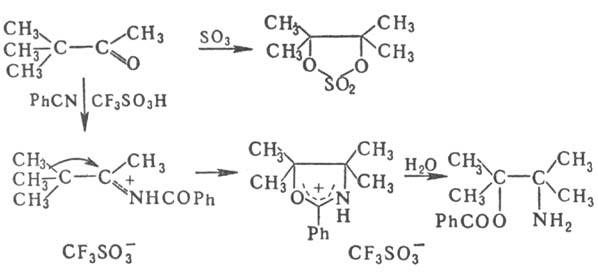
Термин "Р. п."
предложил M. Тиффено в 1907 применительно к превращ. пинаколинового спирта в
тетраметил-этилен:
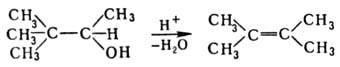
П. п. и P. п. относятся
к Вагнера-Mеервейна перегруппировкам.
Лит.: Беккер Г.,
Введение в электронную теорию органических реакций, пер. с нем., M., 1977, с.
541-85; Темникова T. И., Семенова CH., Молекулярные перегруппировки в органической
химии, Л., 1983, с. 256; Боро-даев С. В., Лукьянов С. M., Жданов Ю. А., "ДАН
СССР", 1986, т. 287, № 4, с. 862-65. C. M. Лукьянов.
|

