НАТРИЯ ПЕРХЛОРАТ
NaClO4,
бесцв. кристаллы; до 306 °С устойчива ромбич. модификация - фаза I (а = 0,7085 нм, b = 0,6526, с = 0,7048, пространствю группа D2h17,
плотн. 2,495 г/см3), выше 306°С-кубич. фаза IV (при 315 °С
а = 0,708 нм; пространств. группа О5h);
DH перехода I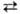 IV
1,30 кДж/моль. Существуют две фазы Н.п. высокого давления - фаза II со структурой
типа AgMnO4, устойчивая при давлении 2,3-3,0 ГПа, и фаза III со структурой
барита, устойчивая при давлении выше 3,0 ГПа. Для Н. п. т. пл. 469 °С (с
разл.); С0р 110,3 Дж/(моль.К);
DH0обр -383,5 кДж/моль; S0298
143,9 Дж/(моль.К). Медленный распад Н.п. начинается вблизи т-ры плавления,
быстрый-в интервале 490-600 °С, продукты распада-NaCl и О2. Добавки
Со3О4, MnO2, Na2O2 и
др. оксидов понижают т-ру разложения Н.п. на 150-200°С.
IV
1,30 кДж/моль. Существуют две фазы Н.п. высокого давления - фаза II со структурой
типа AgMnO4, устойчивая при давлении 2,3-3,0 ГПа, и фаза III со структурой
барита, устойчивая при давлении выше 3,0 ГПа. Для Н. п. т. пл. 469 °С (с
разл.); С0р 110,3 Дж/(моль.К);
DH0обр -383,5 кДж/моль; S0298
143,9 Дж/(моль.К). Медленный распад Н.п. начинается вблизи т-ры плавления,
быстрый-в интервале 490-600 °С, продукты распада-NaCl и О2. Добавки
Со3О4, MnO2, Na2O2 и
др. оксидов понижают т-ру разложения Н.п. на 150-200°С.
Р-римость Н.п. при 25°С
(г в 100 г р-рителя): в воде-209,6, метаноле-51,3, этаноле-14,7, ацетоне-51,7,
этилаце-тате-9,65. Из водного р-ра выше 52 °С кристаллизуется безводный
Н.п., в интервале от 52 до — 13 °С - моногидрат, от —13 до -39°С-дигидрат;
в интервале от 0 до 52 °С ур-ние температурной зависимости давления диссоциации
моногидрата lgр(мм рт.ст.) = 10,51 -2906/T. Н.п. образует
сольваты NaClO4.nL, где n=1 (L-N2H4;
гексаметил-фосфотриамид, т. пл. сольвата 174°С), 4(NH3); 2 (метил-формамид,
т. пл. сольвата 45 °С), 3 (диоксан). Сольваты Н. п. с орг. в-вами взрывоопасны.
Т-ра эвтектики в системе NaClO4-LiClO4 208°С (27,5
мол. % Н.п.), NaClO4-NaOH 243°С (15 мол. % Н.п.), NaClO4-NaCl
417°С (85 мол. % Н.п.). С перхлоратами Al, Zn, Cd и др. Н.п. образует комплексные
перхлоратометаллаты, напр. Na2[Al(ClO4)5],
Na[Zn(ClO4)3], Na[Cd2(ClO4)5].
Получают Н.п. электролизом
водного р-ра NaClO3 или NaCl с анодом из Pt или РbО2,
нанесенных на графит, при 30-60°С и плотн. тока 15-52 А/дм2.
Н.п.-исходный продукт в произ-ве NH4ClO4, компонент смесевых
ВВ, пиро-техн. составов, напр. пиротехн. источников О2.
Лит.: Шумахер И.,
Перхлораты. Свойства, производство и применение, пер. с англ., М., 1963.
В. Я. Росоловский.
|

