НАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ
(предельные углеводороды), орг. соед., углеродные атомы к-рых соединены
между собой простыми (ординарными) связями. В статье рассмотрены алифатич. насыщ.
углеводороды общей ф-лы СnН2n+2 (алканы,
парафины, метановые углеводороды). О циклич. Н.у. см. в ст. Алщиклические соединения.
Номенклатура. Различают
неразветвленные (нормальные) и разветвленные Н.у. Названия первых четырех членов
гомологич. ряда-метан, этан, пропан, бутан; названия последующих членов ряда
состоят из основы-греч. числи-тельного-и окончания "ан", напр. С5Н12-пентан,
С8Н18-октан, С20Н42-эйкозан; гексадекан
в техн. литературе часто наз. цетаном; для названия углеводородов, имеющих одну
или две боковые СН3-группы при втором атоме углерода цепи, используют
соотв. префиксы "изо" и "нео", напр. (СН3)2СНСН2СН3-изопентан,
(СН3)3ССН3-неопентан. Названия разветвленных
Н.у. образуют из названия неразветвленных, к-рым соответствует наиб. длинная
цепь с обозначением места боковой цепи цифрами. Для Н.у. возможна структурная
изомерия (начиная с С4) и оптическая (начиная с С7); число
возможных изомеров возрастает с увеличением числа атомов С.
Распространение в природе.
Осн. источник Н.у. в природе-нефть; фракции нефти 200-430 °С содержат
30-50% (по массе) Н.у. (из них до 60% углеводородов нормального строения); низшие
газообразные Н.у. входят в состав прир. газа (до 98% метана) и растворены в
нефти; твердые встречаются в виде залежей озокерита, а также образуют восковые
покрытия листьев, цветов и семян растений, входят в состав пчелиного воска.
Свойства. Длины
связей С—С в Н.у. ~ 0,154 нм, С—Н ~0,109 нм, угол ССС в газообразном состоянии
109,47°, в кристаллическом-на 2-3° больше.
Низшие Н.у. до бутана и
неопентан-газы без цвета и запаха, углеводороды С5-С17-бесцв.
жидкости с характерным "бензиновым" запахом, высшие Н.у.-бесцв.
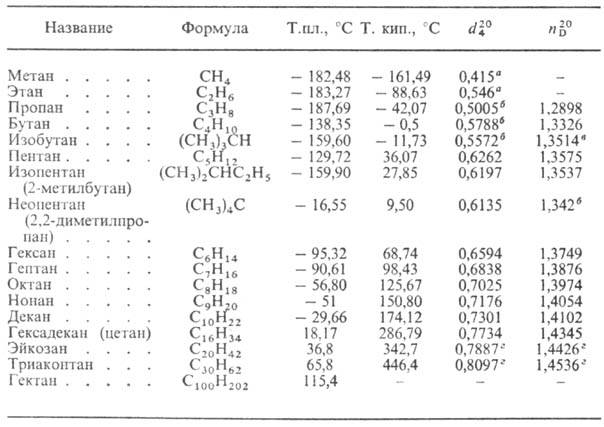
твердые в-ва. Физ. св-ва нек-рых Н.у. приведены в таблице. Т-ры плавления и
кипения зависят от размера молекулы и возрастают в гомологич. ряду с увеличением
мол. массы. Среди изомеров углеводороды нормального строения имеют наиб. высокие
т-ры кипения и плотности. Кристаллич. Н.у. с четным числом атомов С (имеют моноклинную
сингонию) плавятся выше, чем соседние члены гомологич. ряда с нечетным числом
атомов С (кристаллизуются в ромбич. сингонии); чем симметричнее молекула Н.у.,
тем выше т-ра плавления. Большинство Н.у. имеют неск. аллотропич. модификаций.
Н.у. обладают большой теплотворной способностью; DH0сгор
(МДж/кг) для СН4 - 56, для С4Н10 - 50, для
С8Н18 — 48, а также характеризуются высоким уд. электрич.
сопротивлением. Н.у. практически не раств. в воде и не растворяют ее. В Н.у.
раств. галогены, S, Р и нек-рые неорг. соли, напр. BF3, СоСl2,
NiCl2. Р-римость Н.у. падает по мере увеличения полярности р-рителя:
они хорошо раств. в углеводородах, их галогенопроизводных, в эфирах; хуже-в
этаноле и пиридине; мало раств. в метаноле, феноле, анилине, нитробензоле; практически
не раств. в глицерине и этиленгликоле.
ФИЗИЧЕСКИЕ СВОЙСТВА
НЕКОТОРЫХ НАСЫЩЕННЫХ УГЛЕВОДОРОДОВ
a
При т.кип. b В жидком состоянии под давлением. в
При - 25 °С. г Переохлажденная жидкость.
ИК спектры Н.у. имеют характеристич.
полосы 2850-3000см-1 (С -Н), 1400-1470 см-1 (деформационные
колебания связи С—Н в СН3- и СН2-группах) и дополнит.
слабую полосу СН3-группы при 1380 см-1. Чистые Н.у. не
поглощают в УФ области выше 200 нм и поэтому в УФ спектроскопии их часто применяют
в качестве р-рителей. В спектре ЯМР хим. сдвиги d для СН3-групп 0,9
м.д., для СН2-групп 1,25 м.д. В масс-спектрах практически всех Н.у.
присутствует мол. ион, хотя и малоинтенсивный, и ионы с m/z = 14n
+ 1; наиб. интенсивны пики ионов с m/z 43 и 57.
Н.у. относятся к наим.
реакционноспособным орг. соед., однако они не являются химически инертными.
При определенных условиях они вступают в р-ции окисления, галогени-рования,
нитрования, сульфохлорирования и др. Наиб. инертны метан и этан.
Высокотемпературное окисление
Н.у. в избытке О2 приводит к их полному сгоранию до СО2
и воды и протекает по цепному радикальному механизму. Такое окисление происходит
в двигателях всех типов. Низкотемпературное жидкофазное окисление Н.у. О2
в присут. солей Мn приводит к образованию смеси предельных к-т. Этот процесс
используют в пром-сти для получения СН3СООН из бутана и низкокипящих
фракций нефти, а также при произ-ве жирных к-т С12-С18
окислением твердых Н.у. При газофазном окислении при низких т-рах образуются
спирты, альдегиды, кетоны и к-ты (окислители - соед. переходных металлов); в
пром-сти газофазное окисление используется в произ-ве ацетальдегида, метанола
и формальдегида.
Нагревание Н.у. без доступа
воздуха выше 450 СС приводит к гомолитич. разрыву связей С—Сu образованию
олефинов (термич. крекинг). Пром. значение имеет пиролиз легких нефтяных фракций
в этилен. В отличие от термического каталитич. крекинг Н.у. протекает по ионному
механизму и служит для получения высокооктановых бензинов из более тяжелых фракций
нефти. В присут. Н2 под давлением и катализаторов (Ni, Pt) идет гидрогенолиз
(гидрокрекинг) с образованием Н.у. меньшей мол. массы. Каталитич. риформинг
на Pt/Al2O3 приводит к дегидроциклиза-ции Н.у. в ароматич.
и циклопентановые углеводороды и сопровождается гидрокрекингом и изомеризацией.
При дегидрировании Н.у. на разл. катализаторах при 500-600 °С образуются
олефиновые и диеновые углеводороды, в присут. АlСl3 или Pt/Al2O3
Н.у. нормального строения изомеризуются в Н.у. с разветвленной углеродной цепью.
Галогены (F, Cl, Вr) легко
реагируют с Н.у., образуя моно-и полигалогенопроизводные. Иод, как правило,
не реагирует. Для хлорирования м.б. использованы SO2Cl2,
ICl, трет-
бутилгипохлорит и дихлориодбензол, для фторирования-CoF3.
Хлорирование Н.у. с длинной углеродной цепью сопровождается разрывом связей
С—С. Галогенирование Н.у. протекает по радикальному механизму, в сильнокислотных
средах (в присут. SbF5, AlCl3) возможен ионный механизм
р-ции.
Нитрование Н.у. HNO3
или N2O4 в газовой фазе приводит к образованию смеси нитропроизводных
и протекает по радикальному механизму с разрывом связей С—С (р-ция Коновалова).
По ионному механизму протекает нитрование устойчивыми нитрониевыми солями, напр.
NOPFeT в р-рах HF или HSO3F. Н.у. вступают в р-ции сульфохлорирования
и сульфоокисления; образующиеся соед. используют в синтезе ПАВ. Обработка Н.у.
нитрозилхлоридом или смесью NO
и Cl2 приводит к нитрозоалканам-промежут. продуктам в произ-ве полиамидов.
При фосфонилировании смесью РСl3 и О2 образуются дихлориды
фосфоновых к-т, а при карбоксилировании фосгеном или оксалилхлоридом-ацил-хлориды.
Для Н.у. характерно образование
клатратных соед. (см. Газовые гидраты
). Н.у. нормального строения, начиная
с гексана, образуют комплексы с мочевиной, что используется в пром-сти при карбамидной
депарафинизации нефтепродуктов. Н.у. изостроения образуют аналогичные соед.
с тиомочевиной, циклодекстрином и холевой к-той. Низшие газообразные Н.у., особенно
под давлением, склонны к образованию клатратных соед. с водой (6 молекул воды),
к-рые могут вымерзать на внутр. стенках газопроводов.
Получение. В пром-сти
Н.у. получают в составе техн. продуктов или выделяют из них при переработке
нефти и прир. газа, а также угля и горючих сланцев. Смесь разл. алканов м.б.
получена синтезом на основе СО и Н2. Твердые Н.у. нормального строения
получают при депарафинизации масляных дистиллятов нефти (см. Парафин
); смеси
состава С36-С55 (см. Церезин)-очисткой озокерита.
В лаб. условиях Н.у. получают
гидрированием олефинов на катализаторах (Pt, Pd, Ni, Rh); восстановлением гало-генопроизводных
Н.у. амальгамой Na, гидридами металлов, а также Н2 на Pd/BaCO3;
по р-ции Вюрца [в основном симметрич. Н.у. (1)]; гидролизом реактивов Гриньяра
(2); окислит. декарбоксилированием к-т (3) (полученные Н.у. содержат на 1 атом
углерода меньше, чем исходная к-та). Н.у. образуются также при фотохим. декарбоксилировании
первичных карбоновых к-т Рb(ОСОСН3)4 в СНСl3
или электрохим. синтезом Кольбе (4):
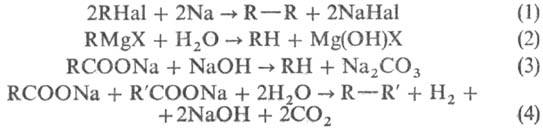
Применение. Н.у.
применяют гл. обр. в составе моторных и реактивных топлив, как сырье для хим.
и нефтехим. пром-сти; жидкие Н.у. и хлорпроизводные метана и этана используют
в качестве р-рителей, твердые (парафин, церезин)-в произ-ве пластмасс, каучуков,
синтетич. волокон, моющих средств, а также в пищ. пром-сти, электро- и радиотехнике.
Лит.: Петров Ал.
А., Химия алканов, М., 1974; его же, Углеводороды нефти, М., 1984; Несмеянов
А. Н., Несмеянов Н. А., Начало органической химии, 2 изд., кн. 1, М., 1974;
Общая органическая химия, пер. с англ., т. 1, М., 1981. А. А. Братков.
|

