МАРГАНЦА ОКСИДЫ
:
MnО, Mn2О3, MnО2, Mn3О4,
Mn2О7, Mn5О8. Кроме Mn2О7,
все оксиды - кристаллы, не раств. в воде. При нагр. высших оксидов отщепляется
О2 и образуются низшие оксиды:
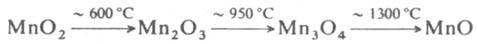
При выдерживании на воздухе или в атмосфере О2 выше 300 °С MnО и Mn2О3 окисляются до MnО2.
Безводные и гидратир. оксиды Mn входят в состав марганцевых и железо-марганцевых руд в виде минералов пиролюзита b-MnО2, псиломелана mМО.nMnО2.хН2О [М = Ва, Са, К, Mn(Н)], манганита b-MnOOH (Mn2О3.Н2О), гроутита g-MnOOH, браунита 3Mn2O3.MnSiO3 и др. с содержанием MnО2 60-70%. Переработка марганцевых руд включает мокрое обогащение и послед. хим. выделение оксидов MnО2 или Mn2О3 методами сульфитизации и сульфатизации, карбонизации, восстановит. обжига и др.
Монооксид MnО (минерал манганозит). До — 155,3 °С устойчива гексагoн. модификация, выше - кубическая (см. табл.). Полупроводник. Антиферромагнетик с точкой Нееля 122 К; магн. восприимчивость + 4,85.10-3 (293 К). Обладает слабоосновными св-вами; восстанавливается до Mn водородом и активными металлами при нагревании. При взаимод. MnО с к-тами образуются соли Mn(II), с расплавом NaOH при 700-800°С и избытке O2 - Na3MnO4, при действии (NH4)2S - сульфид MnS. Получают разложением Mn(OH)2, Mn(C2O4), Mn(NO3)2 или MnСО3 в инертной атмосфере при 300 °С, контролируемым восстановлением MnО2 или Mn2О3 водородом или СО при 700-900 °С. Компонент ферритов и др. керамич. материалов, шлака для десульфуризации металлов, микроудобрений, катализатор дегидрогенизации пиперидина, антиферромагн. материал.
Сесквиоксид Mn2О3 существует в двух модификациях - ромбич. a (минерал курнакит) и кубич. b (минерал биксбиит), т-ра перехода a : b 670 °С; парамагнетик, магн. восприимчивость +1,41•10-5 (293 К); восстанавливается Н2 при 300°С до MnО, алюминием при нагр. - до Mn.

Под действием разб. H2SO4 и HNO3 переходит в MnО2 и соль Mn(II). Получают Mn2О3 термич. разложением MnООН.
Оксид марганца (II, III) Mn3О4 (минерал гаусманит); a-Mn3О4 при 1160°С переходит в b-Mn3О4 с кубич. кристаллич. решеткой; DH0 перехода a : b 20,9 кДж/моль; парамагнетик, магн. восприимчивость + 1,24.10-5 (298 К). Проявляет хим. св-ва, присущие MnО и Mn2О3.
Диоксид MnО2 - самое распространенное соед. Mn в природе; наиб. устойчива b-модификация (минерал пиролюзит). Известны ромбич. g-MnО2 (минерал рамсделит, или полианит), а также a, d и e, рассматриваемые как твердые р-ры разл. форм MnО2. Парамагнетик, магн. восприимчивость + 2,28.10-3 (293 К). Диоксид Mn - нестехиометрич. соед., в его решетке всегда наблюдается недостаток кислорода. Амфотерен. Восстанавливается Н2 до MnО при 170°С. При взаимод. с NH3 образуются Н2О, N2 и Mn2О3. Под действием О2 в расплаве NaOH дает Na2MnO4, в среде конц. к-т - соответствующие соли Mn(IV), H2O и О2 (или Cl2 в случае соляной к-ты). Получают MnО2 разложением Mn(NO3)2 или Mn(ОН)2 при 200°С на воздухе, восстановлением КMnО4 в нейтральной среде, электролизом солей Mn(II). Применяют для получения Mn и его соед., сиккативов, как деполяризатор в сухих элементах, компонент коричневого пигмента (умбры) для красок, для осветления стекла, как реагент для обнаружения Cl-, окислитель в гидрометаллургии Zn, Cu, U, компонент катализатора в гопкалитовых патронах и др. Активный MnО2, получаемый взаимод. водных р-ров MnSO4 и КMnО4, -окислитель в орг. химии.
Оксид марганца (VII) Mn2О7 (гептаоксид димарганца, марганцевый ангидрид) - маслянистая зеленая жидкость; т. пл. 5,9 °С; плотн. 2,40 г/см3; DH0обр -726,3 кДж/моль. Выше 50 °С при медленном нагревании начинает разлагаться с выделением О2 и образованием низших оксидов, а при более высоких т-рах или высоких скоростях нагревания взрывается; крайне чувствителен к мех. и тепловым воздействиям. Сильный окислитель; при контакте с Mn2О7 горючие в-ва воспламеняются. М.б. получен при взаимод. КMnО4 с HZSO4 на холоду.
Оксид Mn5О8, или Mn2II(MnIVО4)3, - твердое в-во; не раств. в воде; м. б. получен окислением MnО или Mn3О4; легко разлагается на MnО2 и О2.
Из гидроксидов Mn стехиометрич. соед. являются только Mn(ОН)2, MnО(ОН) и НMnО4, другие представляют собой
гидратир. оксиды переменного состава, близкие по хим. св-вам соответствующим оксидам. Кислотные св-ва гидроксидов увеличиваются с возрастанием степени окисления Mn: Mn(ОН)2 < MnО(ОН) (или Mn2O3.xH2O) < MnO2.xН2О < Mn3О4.xН2О < Н2MnО4 < НMnО4. Гидроксид Мn(II) практически не раств. в воде (0,0002 г в 100 г при 18 °С); основание средней силы; раств. в р-рах солей NH4; на воздухе постепенно буреет в результате окисления до MnО2.xН2О.
Гидроксиоксид Mn(III) MnO(OH) известен в двух модификациях; при 250 °С в вакууме обезвоживается до g-Mn2О3; в воде не раств. Прир. манганит не разлагается HNO3 и разб. H2SO4, но медленно реагирует с H2SO3, искусственно полученный легко разлагается минер. к-тами; окисляется О2 до b-MnО2. См. также Манганаты
.
М.о. токсичны; ПДК см. в ст. Марганец
.
Лит.: Позин М. Е.. Технология минеральных солей, 4 изд., ч. 1 2, Л., 1974.
П. М. Чукуров.
|

