КЛАСТЕРЫ
(от англ, cluster, букв. - пучок, рой, скопление), группы близко расположенных, тесно связанных друг с другом атомов, молекул, ионов, иногда ультрадисперсные частицы. На стыке ряда областей науки (неорг. и элементо-орг. химии, катализа, коллоидной химии, физикохимии ультрадисперсных систем, физики пов-сти и спец. материаловедения) сложилось новое научное направление - химия К. Понятие "К." пока не имеет четкой определенности и иногда используется для обозначения совершенно разных систем. В химии большинство ученых под назв. "К." чаще всего имеют в виду кластерные соед., общим структурным признаком к-рых является наличие остова из атомов элемента-кластерообразователя, и кластерные частицы; материалы, содержащие К., наз. кластерными материалами. Кластерные соединения. наиб. изучены кластерные соед. металлов. Их молекулы содержат окруженный лигандами остов (ячейку) из атомов металлов, находящихся на расстояниях (не более 0,35 нм), допускающих прямое взаимод. металл-металл. По числу атомов металла, образующих остов кластерного соед., - нуклеарности (q)-К. делят на малые (q = 3-12), средние (q = 13-40), крупные (q=41-100) и сверхкрупные, "гигантские" (q>100; см. рис.). Структура металлич. остова в молекулах К. может быть построена из
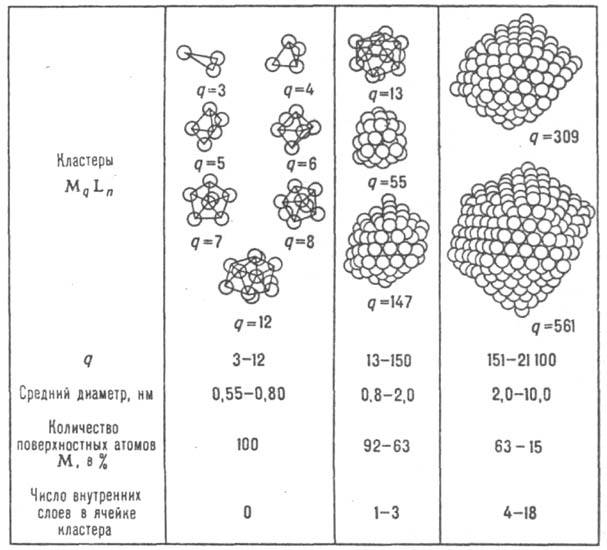
q/n<1 q/n~1 q/n>1 q>n
Кластерные соединения металлов (показаны только остовы кластеров).
цепей разл. длины и разветвленности, напр. H2Sn2[Mn(CO)5]4 (ф-ла I), циклов, напр. Mo3S7Cl4 (II), полиэдров, напр. [Мо6Сl8]4+ (III), она м. б. каркасной, а также представлять собой комбинацию из перечисл. структурных элементов. Из
возможных полиэдров чаще всего реализуются те, стороны к-рых - правильные треугольники, напр. октаэдр III.
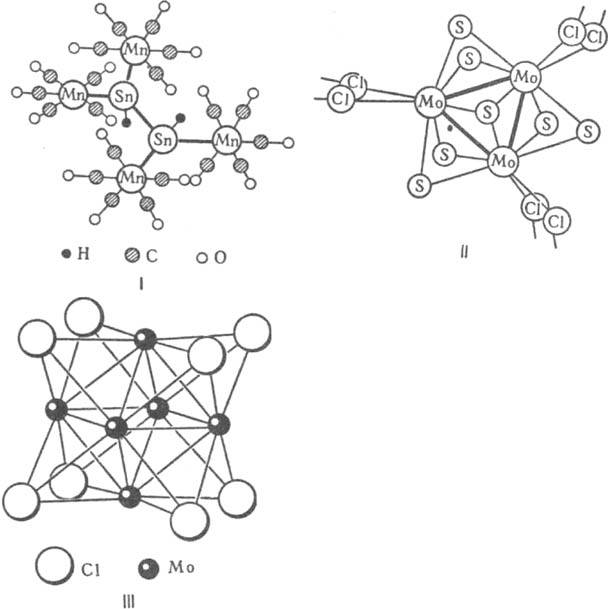
Кластерные соед. характерны как для переходных металлов, так и для многих непереходных. Известны гомометаллич. К., остов к-рых состоит из атомов одного металла, и гетерометал-лич. К., содержащие в остове атомы двух, трех и более металлов. Металлич. остов в молекулах К. покрыт плотным слоем лигандов, как концевых, так и мостиковых. Лигандами м. б. отдельные атомы (Н, Cl, Br, I, Se и др.), группы атомов (CR, ЭL) или молекулы (СО, NO, олефи-ны, арены и др.). Иногда моноатомные лиганды (N, С, Н, Р и др.) расположены внутри полостей металлич. остова, имеющего с внеш. стороны др. лиганды. Существует глубокое топологич. соответствие между строением кластерных соед. металлов и полиэдрич. соед. неметаллов (В, Р, As и др.). Изолобальной аналогии принцип
позволяет, напр., заменить атомы В в полиэдре на металлсодержащие группы с образованием металлоборанов - соед., занимающих промежут. положение между каркасными неметаллич. соед. (часто также наз. кластерными) и металлич. К. Из рассмотрения структуры, электронного строения, энергетики известных К. следует, что на основе любого элемента периодич. системы м. б. реализованы кластерные соединения.
Назв. простейших К. строятся в соответствии с номенклатурными правилами ИЮПАК для координационных соединений
, напр.: [Со6С(СО)14]- - карбидогекса-m-карбонил-октакарбонил-полиэдро-гексакобальт(1-)-ион; Ru4CO12(C2Ph2)-дифенилацетилен-клозо-тетракис-(тикарбонилрутений). Однако в связи с большой сложностью таких названий и трудностями, возникающими при использовании тех же правил для К. с большей нуклеарностью, К. обычно обозначают брутто-формулами и структурными ф-лами.
Электронное строение. Теория хим. связи в кластерных соед. находится в стадии разработки. В большинстве теоретич. работ устанавливают связь между общим числом т. наз. кластерных валентных электронов (КВЭ) и строением остова. Общее число КВЭ вычисляют по след. схеме: к суммарному числу электронов валентных оболочек атомов металлов, образующих остов молекулы К., прибавляют число электронов, предоставляемых лигандами по обычным правилам (см. Металлоорганические соединения
); для кластерных ионов прибавляется также заряд К., взятый с обратным знаком. Напр., для H2Ru6(CO)18 число КВЭ=(6.8)Ru+(2.18)co+(2.l)H=86, для Со6(СО)16 (6.9)Со+(2.16)со=86, для [Со6(СО)15]2- (6.9)Со+(2.15)со+2=86. Осн. особенность небольших полиэдрич. К.-существование "магических" чисел КВЭ, определяющих геометрию полиэдров, что особенно хорошо соблюдается для разл. К. переходных металлов однотипного строения. Изменение числа валентных электронов приводит к перестройке металлополиэдра. Так, для треугольных К. магическое число КВЭ
равно 48, для тетраэдрических - 60, для октаэдрических - 86. Однако оказалось, что кол-во К. с числом КВЭ, отличным от магического, сравнимо с кол-вом К., имеющих магическое число КВЭ.
Квантовохим. расчет молекул кластерных соед. основан на приближении линейной комбинации орбиталей (см. ЛКАО - приближение
). При этом, исходя из данных об энергиях и форме отдельных фрагментов молекул К., составляют орбитали, локализованные на фрагментах, затем получают делокализованные мол. орбитали (МО) кластерной молекулы в виде линейной комбинации МО, локализованных на фрагментах. Разработаны два подхода к описанию электронного строения К. с этих позиций. В первом случае (для средних и крупных К.) молекулу МqLn псевдосферич. симметрии разбивают на след. фрагменты: Мq - сферич. металлич. ядро (остов К.) - и окружающая оболочка из лигандов Ln. При ином способе фрагментации молекулу, как правило, низкой нуклеарности делят на одинаковые фрагменты MLm, где m = n/q. В первом подходе МО кластерной молекулы получают, комбинируя "внешние" МО металлич. остова с подходящими по симметрии МО лигандной сферы; при втором подходе МО строят из граничных орбиталей фрагментов MLm с учетом общей симметрии К. Для малых К. в основе существования корреляции между геометрией остова и числом КВЭ лежат значит. энергетич. различия между заполненными связывающими орбиталями и вакантными разрыхляющими. По мере роста размеров К. эти различия уменьшаются и энергия верх, заполненных МО в крупных К. практически совпадает с энергией Ферми (ЕF) для массивного металла; для переходных металлов EF~4-5 эВ близка к энергиям p-орбиталей своб. атомов металлов. Принято, что МО, лежащие ниже р-орбитали своб. атома металла, являются в К. валентными. Эти кластерные валентные МО построены преим. из орбиталей d- и s-типов с частичным вкладом р-орбиталей. Высоколежащие разрыхляющие МО кластерных молекул построены преим. из атомных p-орбиталей с нек-рым вкладом s-орбиталей. При координации лигандов с ядром К. валентные МО модифицируются вследствие участия в связывании, а разрыхляющие МО претерпевают меньшие изменения (из-за большей разницы по энергиям с орбиталями лигандов) и в молекуле реального К. остаются вакантными. Выделяя разрыхляющие МО на молекулярно-орбитальной диаграмме К., рассчитанной по расширенному методу Хюккеля, получают магические числа электронов, к-рые могут разместиться на валентных МО данного кластерного полиэдра при координации его лигандами (см. Молекулярных орбиталей методы
).
Свойства. Кластерные соед. - окрашенные в темные цвета кристаллы [известны отдельные примеры слабоокрашенных или почти бесцв. соед.-Оs3(СО)12 и др.]. Большинство незаряженных К. умеренно растворимы в орг. р-рителях. Соли, содержащие кластерные ионы, раств. только в полярных орг. р-рителях, в редких случаях - в воде. Нек-рые незаряженные К. низкой нуклеарности летучи и их можно исследовать масс - спектрометрически. Большинство К. диамагнитно.
К. участвуют в р-циях двух типов - затрагивающих остов К. и не затрагивающих, когда реагируют только лиганды в лигандной оболочке. Окислит. - восстановит. р-ции включают перенос электронов в остове К., к-рый не сопровождается перестройкой самого остова, но приводит к изменению нуклеарности остова К. (окислит. деградация). Напр., в гетерометаллич. октаэдрич. К. возможны два направления р-ции - элиминирование осн. кластеробразующего элемента или гетероатома. Так, К. состава [Fe6C(CO)16]2- при окислении переходит в пятиядерный нейтральный Fe5C(CO)15, a в К. состава [Fe3M3C(CO)15]-, где М = Rh, Co, при окислении всегда элиминирует Rh или Со.
Р-ции присоединения характерны как для гомо-, так и для гетерометаллич. К., при этом вместе с изменением числа КВЭ происходит и перестройка металлополиэдров. Так, К. с конфигурацией тетрагон. пирамиды (число КВЭ 74) в
зультате р-ций присоединения переходят в октаэдрич. К. (число КВЭ 86).
Разрыв одной из связей металл-металл в остове К., имеющего магическое число КВЭ, как правило, происходит в результате присоединения по этой связи двухэлектронного лиганда; разрыв одной из связей металл-металл сопровождается перегруппировкой остова К., напр. тетраэдр [H3Os4(CO)12]- переходит в "бабочку" H3Os4(CO)12NO. Замещение одного металла на другой при сохранении нуклеарности К. идет в соответствии с принципом изолобальной аналогии металлсодержащих фрагментов. наиб. активны в р-циях замещения галогениды металлов, напр.: [Fe6C(CO)16J2-+RhCl3.H2O:[Fe5RhC(CO)16]-.
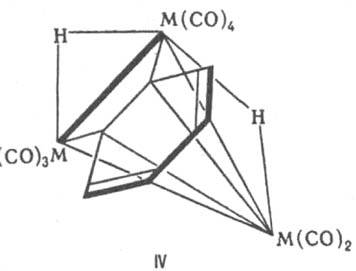
Координация (реберная, граневая) лигандов на неск. металлич. центрах в К. существенно отличается от координации тех же лигандов в моноядерных комплексах, соотв. кардинально меняется и реакц. способность этих лигандов. Напр., необычен способ граневой координации молекул бензола на трех металлич. центрах в трехъядерных кластерах Os и Ru. В отличие от моно- и бис-ареновых комплексов переходных металлов, в к-рых плоская молекула бензола связана с металлом симметрично всеми шестью атомами углерода, в К. координация бензола с металлоциклом осуществляется благодаря одной связи С—С бензольного кольца, при этом два атома Н в качестве мостиковых лигандов переходят в металлоцикл (IV). Молекула этилена
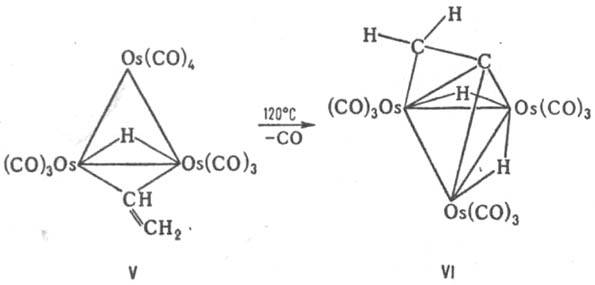
связана с трехъядерным металлоциклом Os3 (реберная координация) посредством одной a- и одной p-связи (V). При нагр. К. винильный лиганд теряет еще один атом Н (к-рый переходит в качестве лиганда в металлоцикл) и перемещается над плоскостью цикла Os3, что приводит к возникновению особого типа граневой координации (VI):
Методы синтеза. Кластерные соед. образуются при восстановлении солей металлов в присут. соответствующих лигандов, напр.:
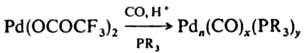
(п=3, х = 3, у=4; n=4, х=5, у = 4; n=10, х=14, у=4; n=23, x=20, у=8; n=38, х=28, у=12). К. получают также термич. или фотохим. отщеплением лигандов от др. К., напр.:
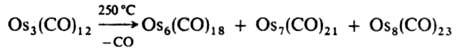
Лиганды СО отщепляются также при действии сильных восстановителей, напр.:
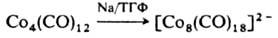
Разработаны менее общие приемы получения К. заданной нуклеарности, напр. при "сдваивании" димеров с кратными связями металл-металл:
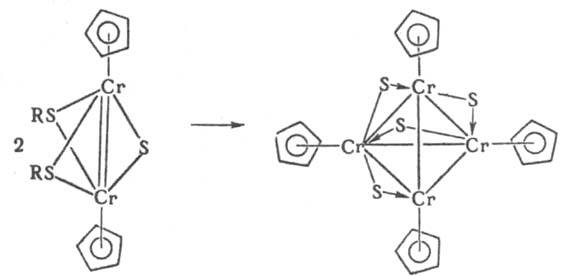
или благодаря "стягивающему" эффекту лигандов:
Кластерные частицы - безлигандные металлич. К. в виде ультрадисперсных металлич. систем или "голых" кластерных ионов. Это особое состояние в-ва, занимающее промежут. положение между кластерными соед., с одной стороны, и коллоидными частицами, чернями, порошками и, наконец, компактными материалами, с другой. Они имеют след. отличит. особенности: доля поверхностных атомов металла соизмерима с числом атомов в объеме частицы; поверхностная и внутр. энергия отдельно взятой частицы также соизмеримы; кристаллич. структура кластерных частиц отличается от структуры массивного образца металла - отсутствует плотная упаковка, увеличены расстояния между атомами и т. д. Форма и структура кластерной частицы носят неравновесный характер и соответствуют состояниям с энергией, отличной от минимальной. В кластерном состоянии могут находиться как любые металлы и сплавы, так и карбиды, нитриды, оксиды, бориды, сульфиды и др., в т. ч. кластерные частицы могут присутствовать в керамич. и композиц. материалах.
Методы получения кластерных частиц основаны на конденсации пара металла. Они отличаются по способам испарения металла (плазменное, термическое в ячейке Кнудсена, электроннолучевое) и по способам конденсации пара металла (сверхзвуковое истечение пара металла в вакуум, испарение в разреженной атмосфере инертного газа-метод газового испарения, криогенная конденсация пара металла на подложку, гомог. нуклеация металлич. пара и др.). Общее условие формирования ультрадисперсных частиц в таких системах - высокая скорость нуклеации при возможно меньшей скорости роста размеров частиц. Особое значение для получения ультрадисперсных частиц имеют взрывные методы; напр., метод электрич. взрыва проводников может с успехом использоваться для получения кластерных частиц трудноиспаряемых тугоплавких металлов. Хим. методы получения кластерных частиц основаны на термич. и фотохим.
разложении соед. металлов с летучими лигандами (карбонилов металлов, солей орг. к-т и др.).
Св-ва кластерных частиц и материалов на их основе сильно зависят от размеров частиц. Однако большинство методов получения кластерных частиц не позволяет контролировать рост К. в такой степени, чтобы получать ультрадисперсные частицы строго определенного и одинакового размера. Даже узкое (с разбросом не более b10%) распределение частиц по размерам - пока еще трудно достижимая цель.
Кластерные материалы. Представляют собой матрицу, в к-рой равномерно распределены металлич. К.-соед. или частицы. Матрицами чаще всего служат карбоцепные полимеры, напр. полиэтилен, графит и цеолиты. Установлена связь уникальных физ. характеристик кластерных материалов (квазиодномерной металлич. проводимости, полупроводниковых, сверхпроводящих, магн. св-в, особенностей взаимод. с излучением и др.) именно с наличием у них значительных взаимод. металл - металл, определяющих тип структуры материалов. Возможность достаточно широкого варьирования межъядерных расстояний металл-металл, природы и числа лигандов, степени окисления металла и др. факторов позволяет создавать материалы с тем или иным типом проводимости.
Разработан ряд методов заполнения каналов в жестких цеолитовых матрицах металлическими К.; таким путем получены К. ртути, железа, серебра и др. Показано, напр., что цеолиты, содержащие К. железа, - хорошие катализаторы синтезов по Фишеру-Тропшу, обладают высокой активностью и селективностью по отношению к метану, устойчивы длит. время и легко регенерируются. Исследуются каталитич. св-ва металлонаполненных полимеров и цеолитов. Найдены условия формирования металлич. К. в полимерных матрицах (полиэтилене, полипропилене, полифениленоксиде и др.) методом высокоскоростного термораспада р-ров соед. металлов в расплавах полимеров. Размер металлич. К. зависит от концентрации металла и природы матриц и находится в пределах 1,5-3,0 нм с узким распределением по размерам; К. расположены периодично в изотропном материале. Такие материалы являются новым классом однофазных металлополимеров с повыш. термич. устойчивостью, улучшенными мех. и необычными магн. и электрич. св-вами.
Применение. Кластерные соед. типа Fe4S4 входят в состав ферментов, таких, как ферредоксины, нитрогеназа, и играют большую роль в ряде важнейших биол. процессов (окисление, фиксация атм. азота и др.). Кластерные группировки -осн. структурные элементы т. наз. фаз Шеврёля [Шевреля] состава PbMo6S8 (см. Молибдена сульфиды
) - сверхпроводящих материалов с высокими критич. т-рами. Цепочки из атомов металлов - осн. структурный элемент квазиодномерных проводящих материалов.
Использование кластерных соед. в качестве катализаторов - важное направление в исследованиях по катализу. К. переходных металлов занимают промежут. положение между гетерогенными и гомогенными (металлокомплексными) катализаторами, сохраняя преимущества тех и других. Разработаны методы закрепления кластерных соед. на пов-сти носителей, в результате чего получен новый тип гетерог. катализаторов - кластерных, перспективных для процессов, в к-рых требуется участие в каталитич. акте нескольких (в т. ч. разных) атомов металлов. Реализованы процессы каталитич. гидрирования и окисления на кластерных палладиевых катализаторах.
Координац. соед. с неск. атомами металла, соединенными мостиковыми атомами неметаллич. элементов, часто наз. "обменными кластерами", рассмотрены в статье Полиядерные соединения
.
Лит.. Петров Ю. И.. Физика малых частиц, М., 1982; Губин С. П., "Вестник АН СССР", 1984, № 1. с. 5-59; его же, "Успехи химии", 1985, т. 54, в. 4. с. 529-55; его же, Химия кластеров. Основы классификации и строение, М., 1987; Петров Ю. И., Кластеры и малые частицы. М., 1986.
С. П. Губин.
|

