ИЗОМЕРИЯ
(от изо
... и греч. meros - доля, часть), существование соединений (гл. обр. органических), одинаковых по составу и мол. массе, но различных по физ. и хим. св-вам. Такие соед. наз. изомерами.
В итоге полемики Ю. Либиха и Ф. Вёлера [Велера] было установлено (1823), что существуют два резко различных по св-вам в-ва состава AgCNO - циановокислое и гремучее серебро. Еще одним примером послужили винная и виноградная к-ты, после исследования к-рых И. Берцелиус в 1830 ввел термин "И." и высказал предположение, что различия возникают
из-за "различного распределения простых атомов в сложном атоме" (т. е. молекуле).
Подлинное объяснение И. получила лишь во 2-й пол. 19 в. на основе теории хим. строения A. M. Бутлерова (структурная И.) и стереохим. учения Я. Г. Вант-Гоффа (пространственная И.).
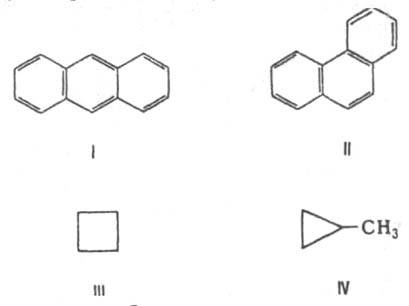
Структурная И. - результат различий в хим. строении. К этому типу относят: 1. И. углеродного скелета, обусловленную разл. порядком связи атомов углерода. Простейший пример - бутан СН3СН2СН2СН3 и изобутан (СН3)3СН. Др. примеры: антрацен и фенантрен (ф-лы I и II соотв.), циклобутан и метилциклопропан (III и IV).
2. И. положения, обусловленную разл. положением функц. групп или кратных связей при одинаковом углеродном скелете, напр. 1-пропанол СН3СН2СН2ОН и 2-пропанол СН3СНОНСН3; 1-бутен СН3СН2СН=СН2 и 2-бутен СН3СН=СНСН2.
Разновидность этого вида И. - существование соед. с разл. взаимным расположением функц. групп или кратных связей (т. наз. И. взаимного положения), напр., a-аминопропионовая к-та CH3CH(NH2)COOH и b-аминопропионовая к-та H2NCH2CH2COOH; метилаллен СН3СН=С=СН2 и 1,3-бутадиен СН2=СНСН=СН2; м-дигидроксибензол (резорцин) и п-дигидроксибензол (гидрохинон). Во всех приведенных выше примерах изомеры имеют одинаковую хим. природу, однако структурные изомеры могут принадлежать к разным классам, напр., ф-лу С6Н6 имеют дивинилацетилен
 и бензол, ф-ла С2Н6О принадлежит этанолу СН3СН2ОН и диметиловому эфиру СН3ОСН3.
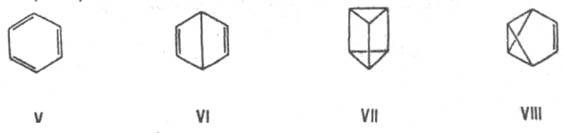
3. Валентную И. (особый вид структурной И.), при к-рой изомеры можно перевести друг в друга лишь за счет перераспределения связей. Напр., валентными изомерами бензола (V) являются бицикло[2.2.0]гекса-2,5-диен (VI, "бензол Дьюара"), призман (VII, "бензол Ладенбурга"), бензвален (VIII).
и бензол, ф-ла С2Н6О принадлежит этанолу СН3СН2ОН и диметиловому эфиру СН3ОСН3.
3. Валентную И. (особый вид структурной И.), при к-рой изомеры можно перевести друг в друга лишь за счет перераспределения связей. Напр., валентными изомерами бензола (V) являются бицикло[2.2.0]гекса-2,5-диен (VI, "бензол Дьюара"), призман (VII, "бензол Ладенбурга"), бензвален (VIII).
Пространственная И. (стереоизомерия) возникает в результате различий в пространств. конфигурации молекул, имеющих одинаковое хим. строение. Этот тип И. подразделяют на энантиомерию (оптическую И.) и диастереомерию.
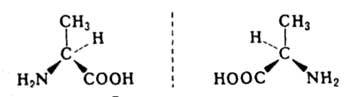
Энантиомерами (оптич. изомерами, зеркальными изомерами) являются пары оптич. антиподов - в-в, характеризующихся противоположными по знаку и одинаковыми по величине вращениями плоскости поляризации света при идентичности всех других физ. и хим. св-в (за исключением р-ций с др. оптически активными в-вами и физ. св-в в хиральной среде). Необходимая и достаточная причина возникновения оптич. антиподов - отнесение молекулы и одной из след, точечных групп симметрии Сn, Dn, Т, O, I (см. Хиральность
). Чаще всего речь идет об асимметрич. атоме углерода, т.е. об атоме, связанном с четырьмя разными заместителями, напр.:
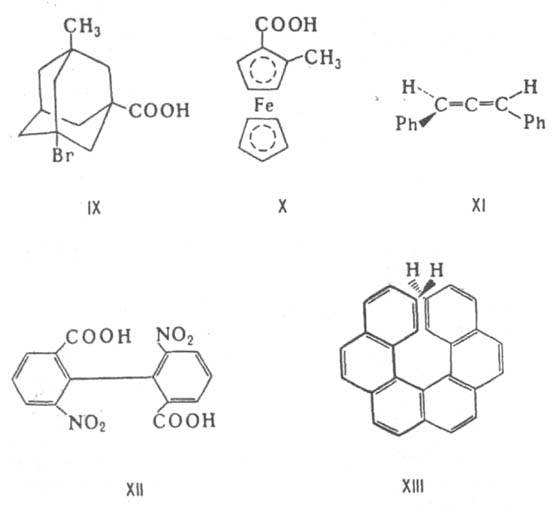
Асимметрическими м. б. и др. атомы, напр., атомы кремния, азота, фосфора, серы. Наличие асимметрич. атома не единств. причина энантиомерии. Так, имеют оптич. антиподы производные адамантана (IX), ферроцена (X), 1,3-дифенилаллен (XI), 6,6-динитро-2,2-дифеновая к-та (XII). Причина оптич. активности последнего соед. - атропоизомерия, т.е. пространств. изомерия, вызванная отсутствием вращения вокруг простой связи. Энантиомерия также проявляется в спиральных конформациях белков, нуклеиновых к-т, гексагелицене (XIII).
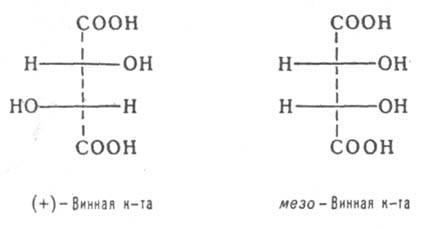
Диастереомерными считают любые комбинации пространств. изомеров, не составляющие пару оптич. антиподов. Различают s- и p-диастереомеры (Д.). s-Д. отличаются друг от друга конфигурацией части имеющихся в них элементов хиральности. Так, Д. являются (+)-винная к-та и мезо-
винная к-та, D-глюкоза и D-манноза, напр.:
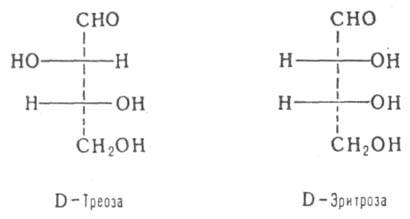
Для нек-рых типов Д. введены спец. обозначения, напр. трео-
и эритро-изомеры - это Д. с двумя асимметрич. атомами углерода и пространств. расположением заместителей у этих атомов, напоминающим соотв. треозу (родств. заместители находятся по разные стороны в проекционных ф-лах Фишера) и эритрозу (заместители - по одну сторону):
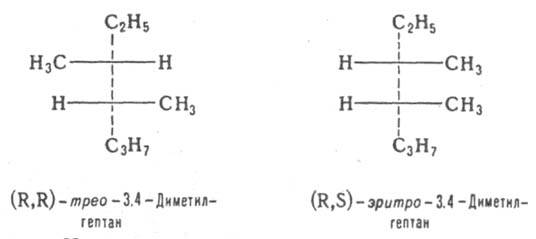
эритро-Изомеры, у к-рых асимметрич. атомы связаны с одинаковыми заместителями, называются мезо
-формами. Они, в отличие от остальных s-Д., оптически неактивны из-за внутримол. компенсации вкладов во вращение плоскости поляризации света двух одинаковых асимметрич. центров противоположной конфигурации.
Пары Д., различающиеся конфигурацией одного из неск. асимметрич. атомов, наз. эпимерами, напр.:
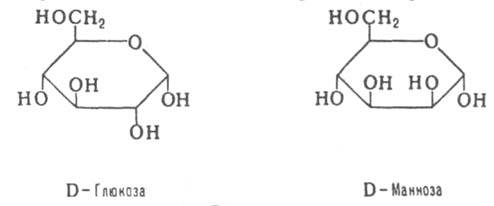
Термин "аномеры" обозначает пару диастереомерных моносахаридов, различающихся конфигурацией гликозидного атома в циклич. форме, напр., аномерны a-D- и b-D-глюкозы.
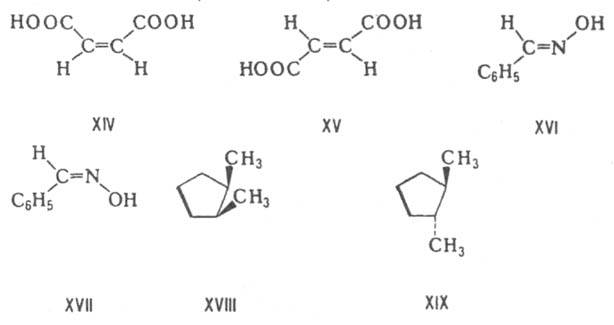
p-Д., называемые также геом. изомерами, отличаются друг от друга разл. пространств. расположением заместителей относительно плоскости двойной связи (чаще всего С=С и С=N) или цикла. К ним относятся, напр., малеиновая и фумаровая к-ты (ф-лы XIV и XV соотв.), (E)- и (Z)-бензальдоксимы (XVI и XVII), цис-
и транс-
1,2-диметилциклопентаны (XVIII и XIX).
Явление И. неразрывно связано с температурными условиями его наблюдения. Так, напр., хлорциклогексан при комнатной т-ре существует в виде равновесной смеси двух конформеров (см. Конфoрмационный анализ
) - с экваториальной и аксиальной ориентацией атома хлора:
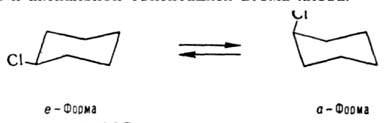
Однако при — 150 °С можно выделить индивидуальную a-форму, к-рая ведет себя в этих условиях как устойчивый изомер.
С др. стороны, соединения, в обычных условиях являющиеся изомерами, при повышении т-ры могут оказаться находящимися в равновесии таутомерами (см. Таутомерия
). Напр., 1-бромпропан и 2-бромпропан - структурные изомеры,
однако при повышении т-ры до 250 °С между ними устанавливается равновесие, характерное для таутомеров.
Изомеры, превращающиеся друг в друга при т-ре ниже комнатной, можно рассматривать как нежесткие молекулы
.
Существование конформеров иногда обозначают термином "поворотная И.". Среди диенов различают s-цuc- и s-транс-изомеры, к-рые, по существу, являются конформерами, возникающими в результате вращения вокруг простой (s-single) связи:
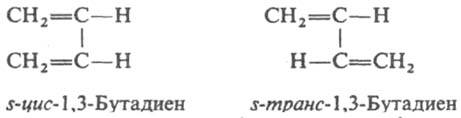
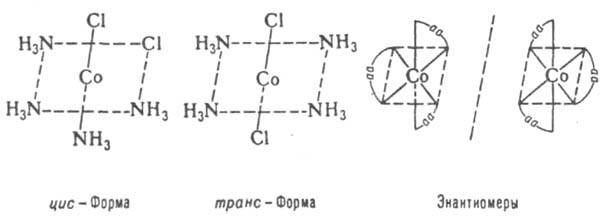
И. также характерна для координационных соединений
. Так, изомерны соед., различающиеся по способу координации лигандов (ионизац. И.), напр., изомерны
[Co(NH3)5Br]+SO4- и [Co(NH3)5SO4]+ Br-.
Здесь, по существу, имеется аналогия со структурной И. орг. соединений. Др. тип И. комплексных соед. обусловлен пространств. причинами (в приводимых ниже ф-лах аа - ацетилацетон):
Хим. превращения, в результате к-рых структурные изомеры превращ. друг в друга, наз. изомеризацией. Такие процессы имеют важное значение в пром-сти. Так, напр., проводят изомеризацию нормальных алканов в изоалканы для повышения октанового числа моторных топлив; изомеризуют пентан в изопентан для послед. дегидрирования в изопрен. Изомеризацией являются и внутримол. перегруппировки, из к-рых большое значение имеет, напр., превращ. оксима циклогексанона в капролактам - сырье для произ-ва капрона.
Процесс взаимопревращения энантиомеров наз. рацемизацией: она приводит к исчезновению оптич. активности в результате образования эквимолярной смеси (-)- и (+)-форм, т.е. рацемата. Взаимопревращение диастереомеров приводит к образованию смеси, в к-рой преобладает термодинамически более устойчивая форма. В случае p-диастереомеров - обычно транс
-форма. Взаимопревращение конформац. изомеров наз. конформац. равновесием.
Явление И. в огромной степени способствует росту числа известных (и еще в большей степени числа потенциально возможных) соединений. Так, возможное число структурно-изомерных дециловых спиртов более 500 (известно из них ок. 70), пространств. изомеров здесь более 1500.
При теоретич. рассмотрении проблем И. все большее распространение получают топологич. методы; для подсчета числа изомеров выведены мат. ф-лы. Для обозначения пространств. изомеров разных типов разработана номенклатура стереохимическая
, собранная в разделе Е Номенклатурных правил ИЮПАК по химии.
Термин "И." употребляют зачастую и за пределами его обычного значения. Так, говорят об изомерии атомных ядер
.
Лит.: Пальм В. А., Введение в теоретическую органическую химию, М., 1974; Соколов В. И., Введение в теоретическую стереохимию, М., 1979; Сланина 3., Теоретические аспекты явления изомерии в химии, пер. с чеш., М., 1984; Потапов В. М., Стереохимия, M., 1988. В. М. Потапов.
|

