ШОТТЕНА-БАУМАНА РЕАКЦИЯ
, ацилирование
спиртов или аминов хлорангидридами карбоновых к-т в присут. водного р-ра
щелочи или соды (акцепторов образующегося НС1):
RCOC1 + HOR + NaOH RCOOR + NaCl + Н2О RCOC1 + H2NR + Na2CO3
RCOOR + NaCl + Н2О RCOC1 + H2NR + Na2CO3 RCONHR
+ NaCl + CO2 + H2O
RCONHR
+ NaCl + CO2 + H2O
В качестве акцепторов НС1 применяют также
NaHCO3, CaO, MgO, CH3COONa. Ацилирующими агентами
обычно являются трудногидролизуемые хлорангидриды ароматич. к-т (напр.,
бензоилхлорид), а также хлорангидриды высших алифатич. к-т (С10-С18).
При ацилировании спиртов выход сложных эфиров повышается с понижением т-ры
р-ции за счет снижения гидролиза хлорангидрида и отчасти эфира. Чтобы избежать
местных перегревов, хлорангидрид прибавляют небольшими порциями к р-ру
спирта в водной щелочи при эффективном перемешивании. Поскольку реакц.
среда должна оставаться слабощелочной до конца р-ции, хлорангидрид и щелочь
берут с 20-25%-ным избытком. Эти же правила применимы и для ацилирования
аминов. Выходы 60-95%.
Ацилирование легкогидролизующимися хлорангидридами
(СОС12, AlkCOCl) проводят в инертных р-рителях (диэтиловый эфир,
хлороформ, бензол) в присут. мелкоизмельченного порошка щелочи или соды.
Аналогично спиртам в р-цию вступают тиолы:
RCOC1 + HSR + NaOH RCOSR + NaCl + Н2О
RCOSR + NaCl + Н2О
Ш.-Б. р. используют для лаб. и пром. получения
разл. сложных эфиров и амидов, напр. бензанилида C6H5NHCOC6H5,
в пром. синтезе ПАВ.
Защиту аминогрупп в аминокислотах при
синтезе пептидов также осуществляют в условиях Ш.-Б. р. Р-цию применяют
в аналит. практике для идентификации хлорангидридов в виде их анилидов
и аминов в виде бензоильных производных.
Метод впервые применен К. Шоттеном в 1884
для ацилирования аминов и Э. Бауманом в 1886 для ацилирования спиртов.
Модификация Ш.-Б. р.- метод Айнхорна,
в к-ром вместо щелочи используют пиридин, служащий одновременно р-рителем
и акцептором НС1:
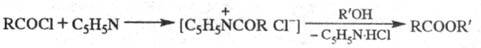
Метод находит широкое применение благодаря
мягким условиям синтеза и высокой ацилирующей способности пиридиниевой
соли. В ряде случаев вместо пиридина используют третичные амины, напр.
(C2H5)3N или (CH3)2NC6H5.
Лит.: Гринштейн Дж., Виниц М., Химия
аминокислот и пептидов, пер. с англ., М., 1965; Вейганд К., Хильгетаг Г.,
Методы эксперимента в органической химии, пер. с нем., М., 1969; Вацуро
К. В., Мищенко Г. Л., Именные реакции в органической химии, М., 1976; Sonntag
N. О., "Chem. Revs.", 1953, v. 52, № 2, p. 238-399.
С. К. Смирнов.

