ГОЛЬМИЙ
(от лат. Holmia-Стокгольм; лат. Holmium) Но, хим. элемент
III гр. периодич. системы; ат. н. 67, ат. м. 164, 9304; относится к редкоземельным элементам (иттриевая подгруппа лантаноидов). В природе один стабильный
изотоп 165Ho. Поперечное сечение захвата тепловых нейтронов
65*10-28м. Конфигурация внеш. электронной оболочки 4f115s25p65d°6s2;степень
окисления +3, редко +2; энергия ионизации Но0->Но+->Но2+->Но3+->Но4+
соотв. 6,02, 11,80, 22,84, 42,48 эВ; атомный радиус 0,176 нм, ионный радиус
Но3+ (в скобках указаны координац. числа) 0,104 нм (6), 0,116
нм (8), 0,121 нм (9), 0,126 нм (10).
Содержание в земной коре 1,3*10-4% по массе, в морской воде
2,2*10-7 мг/л. Вместе с др. РЗЭ находится в минералах монаците,
бастнезите, эвксените, апатите, гадоли-ните.
Г.-металл светло-серого цвета. До 1428 °С устойчив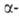 Но: кристаллич. решетка гексаген, типа Mg (a = 0,35773 нм, с = 0,56158 нм, z = 2, пространств. группа P63/mmc; плотн.
8,799 г/см3). Выше 1428°С устойчив
Но: кристаллич. решетка гексаген, типа Mg (a = 0,35773 нм, с = 0,56158 нм, z = 2, пространств. группа P63/mmc; плотн.
8,799 г/см3). Выше 1428°С устойчив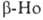 : решетка кубич. типа
: решетка кубич. типа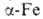 (а = 0,396 нм, z = 2, пространств. группа Im3m; плотн. 8,82
г/см3). Т. пл. 1470°С, т. кип. 2707°С; С? 27,15 Дж/(моль*К);
(а = 0,396 нм, z = 2, пространств. группа Im3m; плотн. 8,82
г/см3). Т. пл. 1470°С, т. кип. 2707°С; С? 27,15 Дж/(моль*К);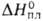 12 кДж/моль,
12 кДж/моль,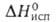 240 кДж/моль; So298 75,45 Дж/(моль*К); давление пара
при 1470°C 42,1 Па; коэф. теплопроводности 22,0 ВтДм*К);
240 кДж/моль; So298 75,45 Дж/(моль*К); давление пара
при 1470°C 42,1 Па; коэф. теплопроводности 22,0 ВтДм*К);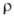 9,0*10-7 Ом*м (273 К); температурный коэф. линейного расширения
9,5*10-6 К-1; предел текучести 222 МПа (20 °С). Ферромагнетик
(точка Кюри 19,4 К). Легко поддается мех. обработке.
9,0*10-7 Ом*м (273 К); температурный коэф. линейного расширения
9,5*10-6 К-1; предел текучести 222 МПа (20 °С). Ферромагнетик
(точка Кюри 19,4 К). Легко поддается мех. обработке.
На воздухе Г. медленно окисляется при ~ 20°С, быстро-выше 100°С. Взаимод.
с минер, к-тами (кроме фтористоводородной), образуя соли Но3
+ ; не взаимод. с р-рами щелочей. При нагр. реагирует с N2,
H2, С12, Вr2, I2, медленно-с
F2 даже при 520 °С.
Оксид (сесквиоксид) Но2О3-светло-желтые кристаллы;
известны модификации с моноклинной решеткой (а = = 1,390 нм, b = 0,3492
нм, с = 0,8592 нм,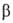 =99,98°,
z = 4, пространств. группа С2/т)и кубическая (а = 1,0607
нм, z = = 16, пространств, группа Ia3; плотн. 2,840 г/см3);
т. пл. 2360°С; С°р 115 Дж/(моль-К);
=99,98°,
z = 4, пространств. группа С2/т)и кубическая (а = 1,0607
нм, z = = 16, пространств, группа Ia3; плотн. 2,840 г/см3);
т. пл. 2360°С; С°р 115 Дж/(моль-К);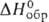 -1881 кДж/моль; S°298 158 ДжДмоль-К); не раств. в воде.
Получают термич. разложением Но2(С2О4)3,
Ho(NO3)3 на воздухе обычно выше 660oC
-1881 кДж/моль; S°298 158 ДжДмоль-К); не раств. в воде.
Получают термич. разложением Но2(С2О4)3,
Ho(NO3)3 на воздухе обычно выше 660oC
Фторид HoF3-белые кристаллы, решетка орторомбическая (а = 0,6404 нм, b = 0,6875 нм, с = 0,4379 нм, z = 4, пространств,
группа Рпта); т. пл. 1143°С, т. кип. > 2200°С; плотн. 7,6442 г/см3;
С°р 87,8 Дж/(моль*К);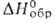 -1700 кДж/моль; не раств. в воде. Получают взаимод. Но2О3
с газообразным HF или водных р-ров солей Но3 с фтористоводородной
к-той, термич. разложением фтор-аммонийных комплексов при 400-500 °С в
атмосфере N2 или Аг, фторированием Г. и др.
-1700 кДж/моль; не раств. в воде. Получают взаимод. Но2О3
с газообразным HF или водных р-ров солей Но3 с фтористоводородной
к-той, термич. разложением фтор-аммонийных комплексов при 400-500 °С в
атмосфере N2 или Аг, фторированием Г. и др.
Хлорид НоС13-светло-желтые кристаллы, решетка моноклинная
(а = 0,685 нм, b = 1,185 нм, с = 0,639 нм,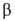 =
= 110,8°, z = 4, пространств, группа С2/т); т. пл. 720°С, т. кип. 1507°С;
плотн. 3,715 г/см3; Сp° 98,3 Дж/(моль*К);
=
= 110,8°, z = 4, пространств, группа С2/т); т. пл. 720°С, т. кип. 1507°С;
плотн. 3,715 г/см3; Сp° 98,3 Дж/(моль*К);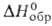 -1006 кДж/моль; раств. в воде. Получают взаимод. смеси С12 и
СС14 с Но2(С2О4)3
выше 200 °С, хлорированием Г. выше 200 °С и др.
-1006 кДж/моль; раств. в воде. Получают взаимод. смеси С12 и
СС14 с Но2(С2О4)3
выше 200 °С, хлорированием Г. выше 200 °С и др.
Г. получают восстановлением HoF3 кальцием. Является компонентом
нек-рых магн. сплавов. В виде соед. ограниченно используется при получении
спец. стекол, как активатор люминофоров и нек-рых материалов микроэлектроники.
Открыт в 1879 П. Клеве. Л. И. Мартыненко, С. Д. Моисеев. Ю.М.
Киселев.

