ГИДРАТАЦИЯ
(от греч. hydor-вода), присоединение воды к молекулам,
атомам или ионам. Может осуществляться без разрушения или с разрушением
молекул воды. Г. без разрушения молекул воды приводит к гидратам. Обусловлена
электростатич. и ван-дер-ваальсовым взаимодействиями, координационными
и иногда водородными связями. Г. в растворе-частный случай сольватации
.
Наиб. изучена Г. ионов в р-рах электролитов. Энтальпии Г. одно-, двух-
и трехзарядных катионов, отсчитанные от их стандартных состояний в вакууме,
имеют порядок соотв. - 400, - 1500 и - 3000 кДж/моль. Первичной Г. наз.
взаимод. ионов только с соседними молекулами воды, вторичной - с более
отдаленными. Координац. числа первичной Г, изменяются от 4 (Be3+)
до 8-9 (La3+ и ионы лантаноидов). Концентрация р-ра, при к-рой
вся вода расходуется на образование только первичных гидратов, наз. границей
полной Г. Экспериментально определяют только суммарные термодинамич. характеристики
Г. катионов и анионов, образующих соли. Эти величины относят к переходу
ионов из вакуума в р-р; разделить их на составляющие для отдельных ионов
можно лишь приблизительно. Точность теоретич. расчетов энергии Г. ионов
квантово-хим. и др. методами в Наиб. благоприятных случаях составляет неск.
процентов.
Г. молекул в р-рах изучена недостаточно. Энтальпии Г. молекул, отсчитанные,
как и для ионов, от их стандартных состояний в вакууме, содержат вклад,
обусловленный влиянием молекул растворенного в-ва на водородные связи между
молекулами воды, и обычно не превышают неск. десятков кДж/моль.
Г.-важный фактор, обусловливающий р-римость в-в в воде, электролитич.
диссоциацию, распределение в-в между фазами в многокомпонентных системах,
содержащих воду, кинетику и равновесие р-ций в водных р-рах, образование
кристаллогидратов (см. также Растворы неэлектролитов
, Растворы электролитов
,
Гидраты
):
Г. с разрушением молекул воды широко распространена в неорг. и орг.
химии. Г. оксидов элементов приводит в зависимости от их природы к образованию
щелочей, к-т или амфотерных гидроксидов. Эта р-ция-основа мн. пром. процессов,
напр. получения серной и азотной к-т, твердения вяжущих материалов (при
этом происходит также образование кристаллогидратов). С.И. Дракин.
Г. орг. соед. обычно осуществляется в р-рах в присут. щелочных или кислотных
катализаторов, а в паровой фазе при повыш. т-рах и давлениях в присут.,
напр., фосфатов Сu, Zn, Cd, оксидов W, А12О3 с разл.
добавками. Широко изучена Г. олефинов. Присоединение воды по двойным связям
олефинов в присут. сильных неорг. к-т, часто вместе с солями ртути, реализуется
по правилу Марковникова и приводит к вторичным и третичным спиртам. Первая
стадия р-ции - медленное присоединение протона по двойной связи с образованием
карбкатиона, к-рый затем быстро реагирует с анионом ОН-. По
такому же механизму происходит Г. ацетиленов, приводящая к карбонильным
соед. (см. также Кучерова реакция
).
Щелочная Г. нитрилов до амидов осуществляется по нуклеоф. механизму.
По этому же механизму гидратируются соед., содержащие электроноакцепторные
заместители (хлораль, мезоксалевая к-та, гексафторацетон) и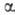 ,
,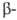 ненасыщенные
карбонильные соединения. Г. лактамов и лактонов с раскрытием цикла может
осуществляться по нуклеоф. и электроф. механизмам аналогично гидролизу
сложных эфиров и амидов.
ненасыщенные
карбонильные соединения. Г. лактамов и лактонов с раскрытием цикла может
осуществляться по нуклеоф. и электроф. механизмам аналогично гидролизу
сложных эфиров и амидов.
Г. непредельных углеводородов-важнейшая стадия во мн. процессах переработки
нефтяного сырья, попутных и прир. газов. Г. используется в пром-сти для
получения, напр., этанола из этилена, изопропанола из пропилена, ацетальдегида
и ацетона из ацетилена, этиленгликоля из этиленоксида, уксусной к-ты и
ее ангидрида из кетена. Г.-одна из стадий синтеза карбоновых к-т из олефинов.
См. также Дегидратация
.
Лит.: Креетов Г. А., Термодинамика ионных процессов в растворах,
2 изд., Л., 1984.

