ФОСФОРА КИСЛОТЫ
,
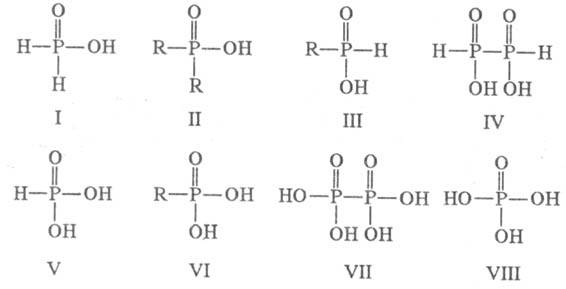
кислородные к-ты фосфора в степенях окисления от +1 до +5. Построены из структурных
единиц XYP(O)OH, где X и Y - О, P, H либо орг. радикал (см. Фосфорорганические соединения
). Сокращенная запись ф-л
Ф. к. по Блазеру и Вормсу
(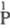 -к-та,
-к-та,
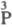 -к-та и
т. д., в индексе над атомом P указывается его степень окисления) позволяет различать
изомеры к-т одинакового состава, напр. изомеры к-ты H4P2O5
- к-ты
-к-та и
т. д., в индексе над атомом P указывается его степень окисления) позволяет различать
изомеры к-т одинакового состава, напр. изомеры к-ты H4P2O5
- к-ты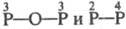 . Примеры Ф. к.:
. Примеры Ф. к.:  -к-ты
- фос-форноватистая (гипофосфористая) H3PO2 (ф-ла I),
фосфино-вые кислоты RRP(O)OH (II), фосфонистые кислоты
RH2PO2
(III);
-к-ты
- фос-форноватистая (гипофосфористая) H3PO2 (ф-ла I),
фосфино-вые кислоты RRP(O)OH (II), фосфонистые кислоты
RH2PO2
(III); 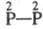 -к-та - гиподифосфорная H4P2O4 (IV);
-к-та - гиподифосфорная H4P2O4 (IV); 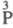 -к-ты
-фосфористая H3PO3 (V), фосфоновые кислоты
RP(O)(OH)2
(VI);
-к-ты
-фосфористая H3PO3 (V), фосфоновые кислоты
RP(O)(OH)2
(VI); 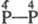 -к-та
- фосфорноватая (гипофосфорная) H4P2O6 (VII);
-к-та
- фосфорноватая (гипофосфорная) H4P2O6 (VII);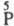 -к-та
- фосфорная кислота
(ортофосфорная) H3PO4 (VIII).
-к-та
- фосфорная кислота
(ортофосфорная) H3PO4 (VIII).
В кристаллич. состоянии
выделены к-ты: одноосновные H3PO2, (НРО3)n;
двухосновные H4P2O5  ,
H4P2O6
,
H4P2O6  ; трехосновные H3PO4, H4P2O5
; трехосновные H3PO4, H4P2O5
 , H4P2O6
, H4P2O6
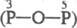 ; четырехосновная H4P2O7
; четырехосновная H4P2O7 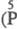 —О—
—О—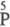 );
пятиосновная H5P3O8
);
пятиосновная H5P3O8 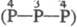 ;
шестиосновная H6P6O12 [циклич., или
;
шестиосновная H6P6O12 [циклич., или 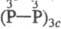 -к-та].
-к-та].
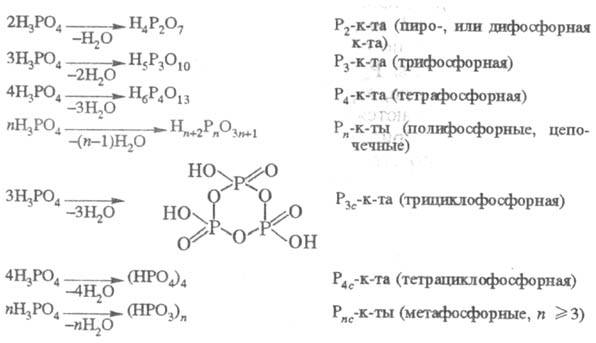
Анионной конденсацией H3PO4
с отщеплением воды получают конденсированные к-ты, в молекулах к-рых тетраэдрич.
группы PO4, соединенные между собой через общий атом О, образуют
цепи (полифосфорные к-ты), кольца (м е -тафосфорные к-ты), разветвленные структуры
(ультрафосфорные к-ты):
При 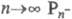 и Рnc-к-ты неразличимы, Молярное отношение H2O:P2O5
= R в гомологич. ряду Pnc-к-т не меняется (R= 1),-в ряду Рn-к-т при росте n уменьшается в пределах
и Рnc-к-ты неразличимы, Молярное отношение H2O:P2O5
= R в гомологич. ряду Pnc-к-т не меняется (R= 1),-в ряду Рn-к-т при росте n уменьшается в пределах
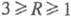 . При
. При
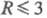 к-ты
представляют собой смеси, состав к-рых характеризуется молекулярно-массовым
распределением анионов. По мере уменьшения R смеси обогащаются высшими
к-тами, при этом вязкость к-т увеличивается вплоть до образования твердой массы.
Вблизи значения R = 1 в смесях появляются Рnc-к-ты,
а также ультрафосфорные к-ты сетчатого строения (область их существования 1,2
к-ты
представляют собой смеси, состав к-рых характеризуется молекулярно-массовым
распределением анионов. По мере уменьшения R смеси обогащаются высшими
к-тами, при этом вязкость к-т увеличивается вплоть до образования твердой массы.
Вблизи значения R = 1 в смесях появляются Рnc-к-ты,
а также ультрафосфорные к-ты сетчатого строения (область их существования 1,2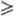 R
R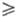 0,7).
В качестве товарного продукта выпускают умеренно вязкую фосфорную к-ту (2,5
>R> 1,5), из к-рой получают жидкие удобрения
и комплексные удобрения. В медицине используют аденозинфосфорные кислоты
(орг.
Рn-к-ты), в орг. синтезе -конц. полифосфорные к-ты. Индивидуальные
к-ты [хроматог-рафически чистые H5P3O10, (НРО3)3
и др.] обычно получают из солей ионным обменом в виде разб. водных р-ров, где
они постепенно разрушаются
по схеме:
0,7).
В качестве товарного продукта выпускают умеренно вязкую фосфорную к-ту (2,5
>R> 1,5), из к-рой получают жидкие удобрения
и комплексные удобрения. В медицине используют аденозинфосфорные кислоты
(орг.
Рn-к-ты), в орг. синтезе -конц. полифосфорные к-ты. Индивидуальные
к-ты [хроматог-рафически чистые H5P3O10, (НРО3)3
и др.] обычно получают из солей ионным обменом в виде разб. водных р-ров, где
они постепенно разрушаются
по схеме: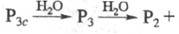
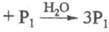 .
.
Это сильные или средней
силы к-ты: для Р3-к-ты рК2 1,2, рК3
2,1, рК4 5,7, рК5 8,6; для P4с-к-тыI
рК1 2,6, рК2 6,4, рК3
8,8, рК4 11,4.
Существуют конденсированные
Ф. к. с разным сочетанием атомов P в разл. степенях окисления. К ним м. б. отнесены
изомеры трифосфорных к-т H5P3O9 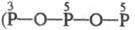 и
и 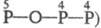 , H5P3O8
, H5P3O8
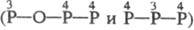 . Известны
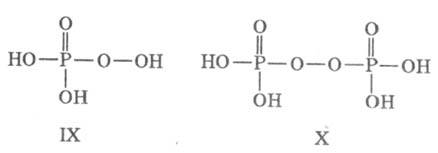
надфосфорные к-ты
с терминальной или срединной пероксо-группой: пероксофосфорная (IX), пероксопирофосфорная
. Известны
надфосфорные к-ты
с терминальной или срединной пероксо-группой: пероксофосфорная (IX), пероксопирофосфорная
Фосфорноеатистая к-та H3PO2:
т.пл. 26,5 0C; плотн. 1,49 г/см3; 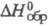 -608,2 кДж/моль; К 8,9·10-2, при нагр. выше 50 0C
начинает разлагаться на PH3, красный P, H3PO4
и H2; хорошо раств. в воде, этаноле, диэтиловом эфире; сильный восстановитель,
напр. при никелировании металлов; образует соли - гипофосфиты неорганические
,
напр. Na(H2PO2)·H2O; получают ее взаимод.
гипофосфитов с H2SO4 или щавелевой к-той, окислением PH3
иодом в слабокислой водной среде; используют как антиоксидант для алкидных смол,
светостабилизатор для полиамидов и поливинилхлори-да, стабилизатор пены при
получении пенополиуретанов.
-608,2 кДж/моль; К 8,9·10-2, при нагр. выше 50 0C
начинает разлагаться на PH3, красный P, H3PO4
и H2; хорошо раств. в воде, этаноле, диэтиловом эфире; сильный восстановитель,
напр. при никелировании металлов; образует соли - гипофосфиты неорганические
,
напр. Na(H2PO2)·H2O; получают ее взаимод.
гипофосфитов с H2SO4 или щавелевой к-той, окислением PH3
иодом в слабокислой водной среде; используют как антиоксидант для алкидных смол,
светостабилизатор для полиамидов и поливинилхлори-да, стабилизатор пены при
получении пенополиуретанов.
Фосфорноеатая к-та H4P2O6:
т. пл. 70 0C; 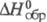 -1638,6 кДж/моль; K1 6·10-3, K2 5·10-3,
К3 5,4·10-8, K4 9,3 · 10-11;
образует моно- и дигидраты, на воздухе расплывается; раств. в воде, в конц.
водных р-рах выше 30 0C разлагается на H3PO3
и H3PO4; окисляется KMnO4 и K2Cr2O7
до H3PO4; получают окислением воздухом р-ров H3PO3
или P, взаимод. хлорной извести с P. Соли H4P2O6
- гипофос -фаты, напр. Na2H2P2O6·6H2O,
Na4P2O6·10H2O; соли щелочных металлов
хорошо раств. в воде, щел.-зем. и тяжелых металлов не раств.; при нагр. в воде
гидролизуются до гипофосфитов и фосфатов.
-1638,6 кДж/моль; K1 6·10-3, K2 5·10-3,
К3 5,4·10-8, K4 9,3 · 10-11;
образует моно- и дигидраты, на воздухе расплывается; раств. в воде, в конц.
водных р-рах выше 30 0C разлагается на H3PO3
и H3PO4; окисляется KMnO4 и K2Cr2O7
до H3PO4; получают окислением воздухом р-ров H3PO3
или P, взаимод. хлорной извести с P. Соли H4P2O6
- гипофос -фаты, напр. Na2H2P2O6·6H2O,
Na4P2O6·10H2O; соли щелочных металлов
хорошо раств. в воде, щел.-зем. и тяжелых металлов не раств.; при нагр. в воде
гидролизуются до гипофосфитов и фосфатов.
Фосфористая к-та H3PO3:
т. пл. 73,6 0C; плотн. 1,65 г/см3; DH0обр-970,6
кДж/моль; K1 5,1 ·10-2, K2 1,8·10-7;
р-ри-мость в воде 75,6% по массе (О 0C), 87,4% (40 0C);
при нагр. в воде окисляется до H3PO4 с выделением H2;
восстановитель, осаждает Pt, Pd, Ag, Au и др. металлы из р-ров их солей; получают
гидролизом PCl3, р-рением P2O3 в воде или взаимод.
солей H3PO3 с H2SO4. Соли H3PO3
- фосфиты, напр. NaH2PO3·2,5H2O; плохо раств.
в воде (кроме солей щелочных металлов); при нагр. разлагаются на ортофосфаты
и производные P в низших степенях окисления; в водных р-рах легко окисляются
до ортофосфатов; получают нейтрализацией H3PO3 гидроксидами
металлов; восстановители в неорг. синтезе, стабилизаторы поливинилхлорида (фосфит
Pb).
Пирофосфорная к-та H4P2O7
существует в двух полиморфных модификациях с т. пл. 54,3 и 71,5 0C,
т. пл. смеси 61 0C; 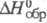 -2248,8 кДж/моль; К1 10-1, K2
10-2, K3 2,7·10-7, K4
2,4·10-10; р-римость в воде 87,6% по массе (23 0C);
образует моно-, пента- и гексагидраты; получают упариванием H3PO4,
взаимод. P2O5 с H3PO4 с послед.
кристаллизацией из р-ра при соотношении H2O: P2O5
= 2, ионным обменом из р-римых в воде пирофосфатов. Соли H4P2O7
-пирофосфаты (см., напр., Натрия фосфаты
).
-2248,8 кДж/моль; К1 10-1, K2
10-2, K3 2,7·10-7, K4
2,4·10-10; р-римость в воде 87,6% по массе (23 0C);
образует моно-, пента- и гексагидраты; получают упариванием H3PO4,
взаимод. P2O5 с H3PO4 с послед.
кристаллизацией из р-ра при соотношении H2O: P2O5
= 2, ионным обменом из р-римых в воде пирофосфатов. Соли H4P2O7
-пирофосфаты (см., напр., Натрия фосфаты
).
О солях и эфирах Ф. к.
см. Фосфаты конденсированные
, Фосфаты неорганические
, Фосфаты органические
,
Фосфиты органические
.
Лит.: Продан Е.А.,
Продан Л.И., Ермоленко H. Ф., Триполи-фосфаты и их применение, Минск, 1969,
с. 286-93; Корбридж Д., Фосфор. Основы химии, биохимии, технологии, пер. с англ.,
M., 1982, с. 112-89.
E. А. Продан.
|

