ФЕРРОЦЕН
[бис(h|-циклопентадиенил)железо],
оранжевые кристаллы; т. пл. 173 0C, т. кип. 249 0C; плотн.
1,49 г/см3 (25 0C); устойчив до 470 0C; возгоняется
при атм. давлении; раств. в орг. р-рителях, не раств. в воде; устойчив к действию
воздуха, горячей конц. водной HCl и 10%-ной водной NaOH.
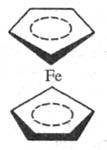
В кристаллич. состоянии
молекула Ф. находится в заторможенной антипризматич. кон-формации; в газовой
фазе может существовать в заслоненной конформации. Молекула непо-лярна, диамагнитна,
связи Fe — С ковалентны. Ф. относится к небензоидным ароматич. си стемам.
Для него характерны три типа хим. превращений: замещение водорода в С5Н5-кольцах
без разрыва связей Fe — С, окисление по атому Fe и разрыв связи Fe-C. Р-ции
электроф. замещения приводят к моно- и гетероаннулярным (содержащим заместители
в разных циклах) дизамещ. Ф.:
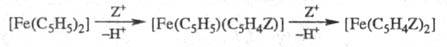
Дизамещенные Ф., содержащие
заместитель в одном цикле (гомоаннулярные) и тризамещенные Ф., образуются в
незна-чит. кол-ве. Таким образом протекают ацилирование, форми-лирование, алкилирование,
сульфирование, аминометилиро-. вание, арилирование, металлирование. Р-ции электроф.
замещения для Ф. протекают легче, чем для бензола. Общее влияние заместителя
на реакц. способность Ф. аналогично влиянию в бензольном ряду. Ярко выраженных
правил ориентации при вступлении второго заместителя в пяти-членное кольцо не
обнаружено. Ферроценильная группа [Fe(C5H5)(C5H4)]
во мн. р-циях переходит без изменения из соединения в соединение.
При взаимод. Ф. с аренами
в присут. AlCl3/Al одно кольцо замещается на арен и образуется катион
[Fе(С5Н5)(арен)]+. Ф.
легко и обратимо окисляется до катион-радикала фер-роцения (окислители: O2
воздуха в кислой среде, HNO3, FeCl3, I2, Ag+,
Cu2+, H2O2, хиноны, N-бромсукцинимид, тетрациано-этилен
и др.):

Окисление протекает без
заметных изменений в геометрии Ф. Разбавленные р-ры солей ферроцения окрашены
в синий цвет, концентрированные - в красный. Катион ферроцения образуется также
при электрохим. окислении Ф. и при действии на него галогенов и орг. пероксидов.
Связь Fe — С в Ф. мало
реакционноспособна; разрывается при действии очень сильных восстановителей:
H2 в присут. Ni-Ренея (300 0C, 2,5 МПа) либо р-ров щелочных
металлов в жидком NH3 или аминах.
Синтезируют Ф. действием
циклопентадиенида Na (Li, К, Tl) или циклопентадиенилмагнийбромида на галогениды
Fe2+ либо из циклопентадиена и соед. Fe, напр.:
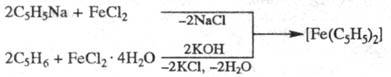
Возможно прямое образование
Ф. из Fe и C5H6 при 300 0C.
Ф. и его производные предложено
использовать в качестве добавок, улучшающих эксплуатац. св-ва моторных масел
и топлив. Полимеры на основе производных Ф. высоко термически стабильны, обладают
ценными электрич. и мага, св-ва-ми. Добавки Ф. оказывают ингибирующее действие
при тер-мо- и фотораспаде и окислении полимерных материалов. Нек-рые производные
Ф. используются как лекарства для лечения железодефицитной анемии (напр., натриевая
соль о-карбоксибензоил ферроцена, или ферроцерон). Предложены светочувствит.
материалы и композиции на основе Ф.
Впервые получен П. Посоном
и др. (1951); его строение установлено P. Вудвордом и Дж. Уилкинсоном, что привело
к бурному развитию химии металлоценов
.
Лит.: Несмеянов
A. H., Ферроцен и родственные соединения. Избранные труды, 1969-1979, M., 1982;
Перевалова Э.Г., Решетова М.Д., Грандберг К.И., Методы элементоорганической
химии. Железоорганиче-ские соединения. Ферроцен, M., 1983. Л. В. Рыбин.
|

